-
甲酸钙广泛用于食品、化工、石油等工业生产上,在300~400℃左右分解。
Ⅰ.实验室制取甲酸钙的方法之一是Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2。实验室制取时,将工业氢氧化钙(含铜离子等杂质)和甲醛依次加入质量分数为30%~70%的过氧化氢溶液中(投料时工业氢氧化钙、甲醛、过氧化氢的物质的量之比为1: 2: 1.2),最终可得到质量分数大于98%且重金属含量极低的优质产品。
(1)铜离子对该实验的影响是________________________________________。
(2)甲酸钙的分解产物为_______________________________。
(3)制备时,在混合溶液中除了要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液。加硫化钠的目的之一是除去重金属离子,其反应的离子方程式为_________________________________。
(4)实验时需强力搅拌45min,其目的是__________________________________。
(5)取ag优质产品[杂质只有Ca(OH)2]溶于水,加入bgNa2CO3(过量),得到cg沉淀,则产品中甲酸钙的百分含量为__________________(列出计算式即可)。
Ⅱ.某研究性学习小组以工业碳酸钙(主要成分为CaCO3,杂质为Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合图中几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算),现提供的试剂有:
a.甲酸钠 b.5mol·L-1的硝酸 c.澄清石灰水
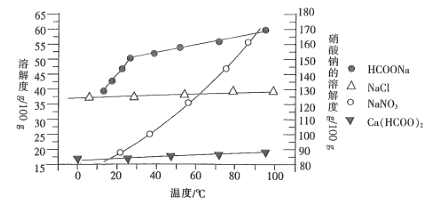
请补充完整由碳酸钙制备甲酸钙的实验步骤:
步骤1:称取13.6g甲酸钠溶于约20mL水中,配成溶液待用,并称取研细的碳酸钙样品10g待用。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤2:_____________________________________________________________。
步骤3:____________________________________________________________________。
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH为7~8,充分搅拌,所得溶液经____________、趁热过滤、洗涤、干燥得甲酸钙晶体。
-
工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:
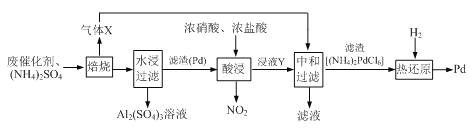
(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________。
水浸与中和步骤得到溶液的操作方法是___________。
(3)浸液Y中含Pd元素的溶质是___________ (填化学式)。
(4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________L。
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:______________________ 。
②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________。
-
研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
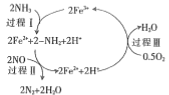
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如下图所示。
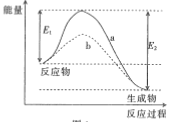
①上图中因为改变了反应条件,反应的活化能b___________(填“>”“<”或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=___________(用E1, E2的代数式表示)
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为剂____,脱硝总反应的化学方程式为:___________。
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密闭容器中,进行反应H2O(g)+CO(g)=CO2(g)+H2(g),得到如表所示的三组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O(g) | CO(g) | CO(g) | H2(g) |
| 1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
| 2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
| 3 | 900 | a | b | c | d | t |
①实验2:4min内,v(CO2)= ___________;900℃时,平衡常数为___________;降低温度时,平衡常数会___________(填“增大”“减小”或“不变”)。
②650℃时,若在此容器中充入2.0molH2O(g)、1.0molCO(g)、1.0molCO2(g)和xmolH2(g),要使反应在开始时间向正反应方向进行,则x应满足的条件是___________。
③若a=2.0,b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(α)的关系为α(H2O)___________(填“>”“<”或“=”)α(CO)。
-
铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_____。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第一电离能I1(Fe)____(填“大于”或“小于”)I1(Mn),原因是___。
(3)FeF3具有较高的熔点(熔点高于1000℃),其化学键类型是__,FeBr3的式量大于FeF3,但其熔点只有200℃,原因是____。
(4)FeCl3可与KSCN、苯酚溶液发生显色反应。
①SCN-的三种元素中电负性最大的是____。
②苯酚( )分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
)分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
(5)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。

-
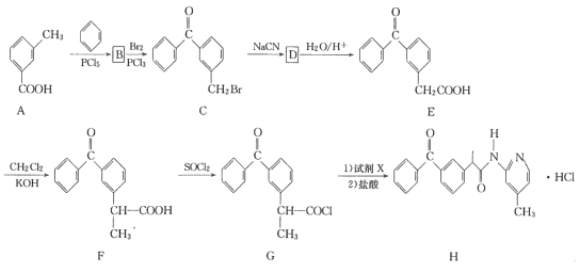
盐酸吡酮洛芬(H)是一种消炎镇痛药,其合成路线如下:
已知R-CN R-COOH
R-COOH
回答下列问题:
(1)A的化学名称是____。
(2)由B生成C的化学方程式为________。
(3)D的结构简式为_______。
(4)F中官能团的名称为_____。
(5)G生成H(试剂X的分子式为C6H8N2)的反应类型是____。
(6)E的分子式为____。X与E互为同分异构体,X的分子中含两个苯环,X水解后产物之一既能发生银镜反应又能与FeCl3溶液发生显色反应,X的核磁共振氢谱显示有6种不同化学环境的氢,峰面积之比为1:2:2:2:2:3。写出符合条件的X的结构简式:____。
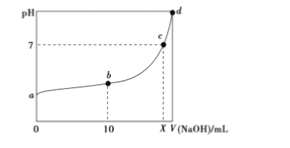
2NO

, 向20ml 0.01mol.L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )