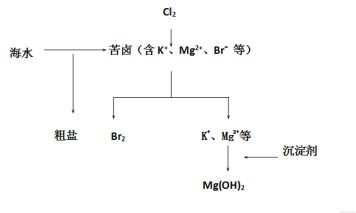
-
下列关于浓硝酸的说法不正确的是
A. 光照易分解
B. 露置于空气中溶液浓度降低
C. 能与碳反应说明其具有强氧化性
D. 常温下铜在浓硝酸中发生钝化
难度: 困难查看答案及解析
-
常温常压下,a、b、c、d四支相同的试管中,分别装入以等物质的量混合的两种气体,a试管内是NO2与O2,b试管内为Cl2和SO2,c试管内为NO与O2,d试管内是NH3与N2,将四支试管同时倒立于水中,最终各试管中水面上升高度顺序应为
A. b>c>a>d B. b>a>c>d C. d>b>a>c D. b>d>c>a
难度: 困难查看答案及解析
-
W、X、Y、Z原子序数依次增大的短周期元素,W元素最外层电子数是内层电子数的两倍,X与Z属于同主族的元素,Z 元素最高正价与最低负价之和为4;Y为短周期元素中半径最大的元素,下列说法正确的是( )
A. 简单离子半径Y>X
B. 非金属性W>Z
C. 氢化物稳定性X>Z>W
D. 最高价氧化物对应水化物的酸性W>Z
难度: 简单查看答案及解析
-
某溶液中含有HCO3-、SO32-、Na+、NO3-四种离子,向其中加入适量Na2O2固体后,假设溶液体积不变,溶液中离子浓度增大的是
A. SO32- B. HCO3- C. Na+ D. NO3-
难度: 中等查看答案及解析
-
下列各种方法中,最适用于炼制相应金属的是
A. 加热氧化铜制铜 B. 氧化铁与铝粉反应制铁
C. 电解熔融氯化铝制铝 D. 电解熔融氧化镁制镁
难度: 中等查看答案及解析
-
你认为减少酸雨的产生可采取的措施是( )
①用煤作燃料 ②把工厂炯囱造高 ③化石燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A. ①②③ B. ①③④⑤ C. ②③④⑤ D. ③⑤
难度: 中等查看答案及解析
-
已知短周期元素的四种离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述中正确的是( )
A. 原子半径:B>A>C>D B. 原子序数:D>C>B>A
C. 离子半径:C3->D->A2+>B+ D. 氧化性:A2+>B+,还原性:C3-<D-
难度: 中等查看答案及解析
-
短周期元素A和B,其中A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成的化合物的化学式可能表示为( )
A. B3A2 B. AB2 C. A3B2 D. BA2
难度: 中等查看答案及解析
-
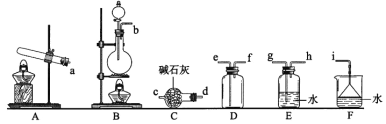
关于下列各装置图的叙述中,正确的是( )
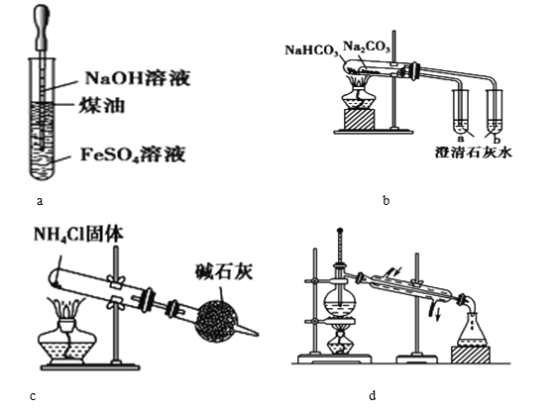
A. 图a制取及观察Fe(OH)2
B. 图b比较两种物质的热稳定性
C. 图c实验室制取NH3
D. 图d分离沸点不同且互溶的液体混合物
难度: 中等查看答案及解析
-
铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与11.2 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )
A. 32 g B. 48 g C. 64 g D. 96 g
难度: 困难查看答案及解析
-
在一定温度和压强下,将一支容积为21mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升一定高度不再变化时,在相同条件下再通入O2,若要使试管内的液面仍保持在原高度,则通入O2的体积为
A. 8.75mL B. 12.25mL
C. 5.25mL D. 10.5mL
难度: 困难查看答案及解析
-
CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是( )
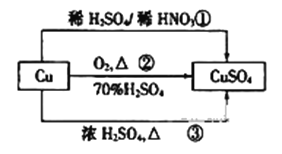
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2:3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mL
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是( )
A. 铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
B. SO2通入氯水中:SO2+Cl2+2H2O=SO42-+2Cl-+4H+
C. Fe(OH)2溶于过量的稀HNO3:Fe(OH)2+2H+=2Fe2++2H2O
D. 少量氯水滴入FeBr2溶液中:Cl2+2Br-=2C1-+Br2
难度: 中等查看答案及解析
-
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是 ( )
A. 肯定有SO2和NO B. 肯定没有O2和NO2,可能有Cl2
C. 可能有Cl2和O2 D. 肯定只有NO
难度: 困难查看答案及解析
-
下列实验操作及现象和后面结论对应正确的是( )
选项
实验操作
现象
结论
A
将SO2通入酸性高锰酸钾溶液
高锰酸钾溶液紫色褪色
SO2具有漂白性
B
向某溶液中滴加KSCN溶液
溶液显红色
原溶液中有Fe3+无Fe2+
C
将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液
有白色沉淀生成
证明酸性:硫酸大于碳酸大于硅酸
D
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列根据实验现象所得出的结论中,正确的是( )
A. 无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32-
B. 某物质焰色反应呈黄色,结论:该物质是钠盐
C. 无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3
D. 无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42-
难度: 困难查看答案及解析
-
已知X+结构示意图如下图,则X在元素周期表中的位置是( )
A. 第二周期0族 B. 第四周期ⅠA族
C. 第三周期ⅠA族 D. 第三周期ⅦA族
难度: 简单查看答案及解析
-
下列关于化学键的叙述中,正确的是 ( )
A. 氢键是一种特殊的共价键
B. 离子化合物中可能含有共价键
C. I2的挥发破坏了共价键
D. 非极性键只能存在双原子单质中
难度: 简单查看答案及解析
-
浅绿色的Fe (NO3)2溶液中逐滴加入少量的稀硫酸时,溶液的颜色变化应该是
A. 颜色变浅 B. 变为血红色 C. 没有改变 D. 变为黄色
难度: 困难查看答案及解析
-
下列有关化学用语的表示方法中正确的是
A. 次氯酸的电子式:
B. M2+离子核外有a个电子,b个中子,M原子符号为a+b+2a+2M
C. 用电子式表示MgCl2的形成过程为:
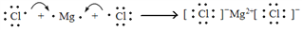
D. Na+的结构示意图:
难度: 简单查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T为铝元素。
元素R的氢化物的电子式为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为
难度: 简单查看答案及解析
-
下列说法正确的是
A. 原子序数之差为2的两种元素不可能位于同一主族
B. D−核外有36个电子,则元素D位于第四周期第ⅦA族
C. 位于同一主族的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4
D. 位于同一周期的甲、乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19
难度: 中等查看答案及解析
-
下列物质中只含有离子键的是
A. H2O B. NH4Cl C. Na2S D. Na2O2
难度: 简单查看答案及解析
-
如图所示,用海带灰制备单质碘的实验中,涉及的操作正确且能达到实验目的的是
A.
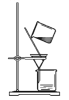 过滤海带灰浸取液
过滤海带灰浸取液B.
 在滤液中通入Cl2
在滤液中通入Cl2C.
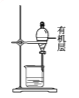 先放出下层液体,再放出有机层苯
先放出下层液体,再放出有机层苯D.
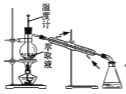 回收萃取剂苯并获得单质碘
回收萃取剂苯并获得单质碘难度: 中等查看答案及解析