-
港珠澳大桥于2018年10月正式开通,这座当今世界里程最长、施工难度最大的跨海大桥使用了大量各类材料:路面使用了进口的湖底天然沥青和混凝土、承台和塔座等部位使用了双相不锈钢钢筋、抗震方面使用了新型高阻尼橡胶和钢板。关于这些材料的说法错误的是( )
A. 沥青主要成分是有机物,也可以通过石油分馏得到
B. 混凝土中含有的水泥、沙子都属于无机非金属材料
C. 不锈钢是通过改变材料的结构的途径防锈蚀
D. 橡胶一定属于合成高分子材料
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值,下列说法错误的是
A. 等物质的量的Na2O和Na2O2中含有的阴离子数均为NA
B. 常温常压下14gCO和N2的混合气体中含有的原子数为NA
C. 1L1mol/L的亚硫酸溶液中氢离子数小于2NA
D. 18g铝溶于NaOH溶液或盐酸转移电子数均为2NA
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A. 分子组成均符合CnH2n +2的两种物质一定互为同系物
B. 丙酸甲酯的同分异构体中属于羧酸的有4种
C. 苯和甲苯都不能使酸性高锰酸钾溶液褪色
D. 实验室制备乙酸乙酯时若将浓硫酸换成稀硫酸产率会降低
难度: 中等查看答案及解析
-
W、X、Y、Z是族序数依次增大的短周期元素,W的族序数与周期数相同,工业冶炼金属X的方法是电解其熔融氯化物,Y、Z的最高价氧化物的水化物分别是一元强酸和二元强酸,下列说法正确的是
A. 原子半径:X >Y>Z>W
B. W分别与Y、Z形成的化合物水溶液均显酸性
C. Z的最高价氧化物的水化物溶液常温下一定能和铁反应
D. X单质常温下可与水剧烈反应
难度: 中等查看答案及解析
-
下列实验操作能达到预期实验目的的是
选项
目的
操作
A
比较S与Cl元素非金属性强弱
测定等浓度Na2S、NaCl溶液的pH
B
制取硅酸胶体
向饱和硅酸钠溶液中加入浓盐酸
C
检验FeCl3溶液中是否含有FeCl2
取少量溶液于试管中,滴加K3[Fe(CN)6]溶液
D
除去Na2CO3溶液中的NaHCO3
向溶液中通入足量CO2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
传统的酸性锌锰电池以NH4Cl溶液为电解质,其电池反应为2MnO2 +Zn +2NH4Cl = 2MnOOH + Zn(NH3)2Cl2,一种改进型防泄漏锌锰电池以ZnCl2溶液作为电解质,其电池反应为8MnO2+ 4Zn+ZnCl2+8H2O=8 MnOOH +ZnCl2·4ZnO·4H2O。关于两种锌锰电池的说法错误的是
A. 两种电池的两极活性材料相同
B. 改进型锌锰电池属于碱性锌锰电池
C. 两种电池的正极反应均为:MnO2+e—+H+=MnOOH
D. 改进型电池防泄漏的主要原因是电池工作时消耗大量的水
难度: 中等查看答案及解析
-
常温下,向10 mL 0.1 mol/L的CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中一lgc(Cu2+)随滴入的Na2S溶液体积的变化如图所示(忽略滴加过程中的温度变化和溶液体积变化)。下列叙述正确的是
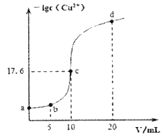
A. 常温下Ksp (CuS)的数量级为10-35
B. c点溶液中水的电离程度大于a点和d点溶液
C. b点溶液中c(Na+)=2c(Cl-)
D. d点溶液中c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+)
难度: 困难查看答案及解析