-
党的十八大报告提出了“建设美丽中国”的宏伟蓝图。节能减排、低碳生活、合理利用资源、保护环境,走可持续发展的道路成为我国发展的重要战略。下列说法不符合这一主题思想的是
A.大力开采煤和石油,促进地方经济发展
B.实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物对环境的污染
C.积极推广太阳能、风能、地热能等新能源的使用,减少化石燃料的使用,有效降低PM2.5对环境的污染
D.对城市生活污水脱氮、除磷,净化处理,遏制水体富营养化
难度: 简单查看答案及解析
-
下列说法正确的是
A.水晶项链和餐桌上的瓷盘都是硅酸盐制品
B.新制氯水中的所有物质都是电解质
C.氮氧化物、二氧化硫是形成酸雨的主要物质
D.制造光导纤维的原料是晶体硅
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是
A.原子核内有10个中子的氧离子:
B.硫离子的结构示意图:
C.NH4Cl的电子式
D.二氧化碳的结构式:O-C-O
难度: 中等查看答案及解析
-
滴加新制氯水后,下列各组离子可能大量存在的是
A.Fe3+、Al3+、Cl-、NO
B.K+、Na+、I-、SO
C.Ag+、Ca2+、NH、NO
D.Na+、Ba2+、CO、SO
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.铝片放入氢氧化钠溶液中:Al+2OH-===AlO2-+H2↑
B.Na与水反应:Na+2H2O===Na++H2↑+2OH-
C.向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-===Al(OH)3↓
D.AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
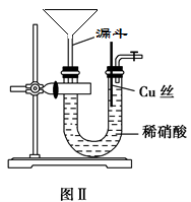
某同学用下列装置制备并检验Cl2的性质。

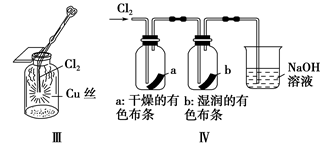
下列说法正确的是
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
难度: 困难查看答案及解析
-
某兴趣小组设计如图装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是

A.钠在氯气中燃烧产生黄色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气已被碱液完全吸收
难度: 中等查看答案及解析
-
下列关于浓硫酸的叙述正确的是
A.浓H2SO4使蔗糖炭化变黑,体现了浓H2SO4的氧化性
B.浓H2SO4使蓝色胆矾变成白色,体现了浓H2SO4的脱水性
C.浓H2SO4滴在润湿的蓝色石蕊试纸,试纸先变红,然后褪色,最后变黑,说明浓H2SO4具有酸性、氧化性和脱水性
D.100 mL 18 mol/L的浓H2SO4中加入足量的Cu并加热,被还原的H2SO4的物质的量为0.9 mol
难度: 中等查看答案及解析
-
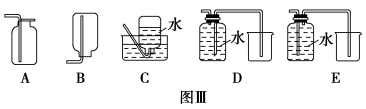
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
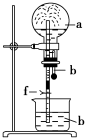
a(干燥气体)
b(液体)
A
NO2
水
B
CO2
水
C
Cl2
饱和食盐水
D
NH3
1 mol·L-1盐酸
难度: 中等查看答案及解析
-
下列由相关实验现象所推出的结论正确的是
A. NH4Cl和NH4HCO3受热都能分解,说明可以用加热NH4Cl或NH4HCO3固体的方法制氨气
B. 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO
C. Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D. 分别将充满HCl、NH3的烧瓶倒置于水中,液面均迅速上升,说明二者均易溶于水
难度: 简单查看答案及解析
-
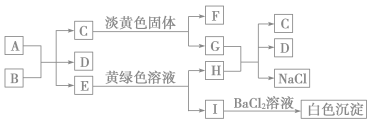
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A.可用KI-淀粉试纸和食醋检验加碘盐中是否含有碘
B.足量Cl2能使湿润的KI-淀粉试纸变白的原因可能是:5Cl2+I2+6H2O===2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO
D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为5NA
难度: 困难查看答案及解析
-
用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
选项
操作及现象
溶液
A
通入CO2,溶液不变浑浊;先通入氨气再通入CO2,溶液变浑浊
CaCl2溶液
B
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
Na2SiO3溶液
C
通入CO2,溶液变浑浊,再加入品红溶液,红色不褪去
Ca(ClO)2溶液
D
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊
Ca(OH)2溶液
难度: 中等查看答案及解析
-
根据陈述的知识,类推得出的结论正确的是
A.磷在足量氧气中燃烧生成一种氧化物,则碳在足量氧气中燃烧也生成一种氧化物
B.稀硝酸能将木炭氧化成二氧化碳,同理稀硫酸也能将木炭氧化成二氧化碳
C.CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似
D.NaHCO3、(NH4)2CO3固体受热后均能生成气体,则Na2CO3固体受热后也能生成气
体
难度: 中等查看答案及解析
-
将3.2 g Cu跟30.0 mL 10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO的物质的量为
A.0.5a mol B.(0.1+a)mol C.0.1a mol D.2a mol
难度: 困难查看答案及解析
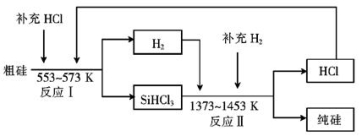
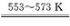 SiHCl3+H2,则反应II的化学方程式为
SiHCl3+H2,则反应II的化学方程式为