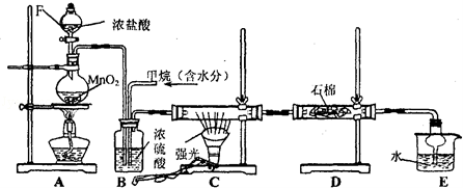
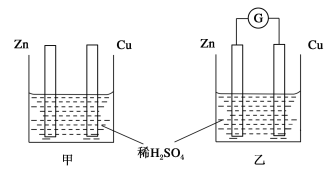
-
下列变化过程,属于放热反应的是( )
①碳与水蒸气生成一氧化碳和氢气 ② 酸碱中和反应
③铝粉与氧化铁粉末反应 ④ 固体NaOH溶于水
⑤ H2在Cl2中燃烧 ⑥ 碳酸钙高温分解
A、②③④⑤ B、②④⑤ C、②③⑤ D、①③⑤
难度: 简单查看答案及解析
-
已知R2+ 离子核外有a个电子,b个中子,则表示R原子符号正确的是

难度: 简单查看答案及解析
-
下列各项中表达正确的是( )
A.F-的结构示意图:
B.CH4分子的比例模型:
C.CCl4的电子式:
D.乙烯的结构简式:CH2CH2
难度: 中等查看答案及解析
-
福岛核电站泄漏的放射性物质中含有I,下列有关I的说法正确的是( )
A.由此可确定碘元素的相对原子质量为131
B. I是碘元素的一种同位素
C.I核素中含中子数为53
D.I2的摩尔质量为262 g
难度: 简单查看答案及解析
-
反应A(s)+B(g)=c(g)在密闭容器中进行,下列情况不能使反应速率加快的是
A.升高温度 B.增加A的物质的量
C.使用催化剂 D.缩小容器体积使压强增大
难度: 中等查看答案及解析
-
电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
难度: 简单查看答案及解析
-
下列有关物质性质的比较正确的是
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:F2>Cl2>Br2>I2
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2- ⑥酸性:HNO3>H3PO4
A.①③ B.②④ C.③⑥ D.⑤⑥
难度: 中等查看答案及解析
-
关于具有相同的电子层结构的短周期元素aA2+、bB+、cC3+、dD-,下列说法中正确的是
A.原子半径C>A>B>D B.价电子数D>C>A>B
C.离子半径C3+>D->B+>A2+ D.单质的还原性A>B>C>D
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数
B.元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共16个纵行
C.除短周期外,其他周期均有18种元素
D.在元素周期表的金属和非金属分界线附近寻找半导体材料
难度: 中等查看答案及解析
-
下列关于物质性质的比较,正确的是
A.稳定性强弱:HF>HCl>HBr>HI B.原子半径大小:Cl>P>N
C.碱性强弱:KOH<NaOH<LiOH D.金属性强弱:Na<Mg<Al
难度: 中等查看答案及解析
-
下列有关反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢
难度: 中等查看答案及解析
-
下列叙述不正确的是 ( )
A.离子化合物可能含共价键 B.共价化合物不可能含离子键
C.离子化合物中只含离子键 D.共价化合物中只含共价键
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与
W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是
A、金属性:Y>Z C、氢化物的稳定性:X>W
B、离子的还原性:X>W D、离子半径:Z>Y>X
难度: 中等查看答案及解析
-
下列说法不正确的是
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎相同
③元素种类由质子数决定,核素种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素
A.①②④ B.③④⑤ C.②③⑤ D.①⑤
难度: 中等查看答案及解析
-
已知 2molH2 完全燃烧生成水蒸气放出热量484kJ,且 1molH—H 键断裂时吸收热量为436kJ,水蒸气中 1molH—O 键形成时放出热量463kJ,则 O2 中 1molO=O键完全断裂时吸收热量( )
A.496 kJ B.188 kJ C.557 kJ D.920kJ
难度: 中等查看答案及解析
-
一定条件下,可逆反应X(g) + 3Y(g)
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2 = 1:3
B.当4v(X)正= v(Y)逆 时,该反应还在向逆反应方向建立平衡
C.X、Y的转化率不相等
D.Y起始浓度c2可能为0.36mol/L
难度: 中等查看答案及解析