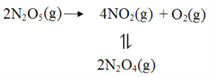-
下列说法正确的是:
A. 淀粉、纤维素、油脂都是高分子化合物
B. 石油分馏和煤的干馏过程,都属于物理变化
C. 聚乙烯是无毒高分子材料,可用于制作食品包装袋
D. 甲烷、汽油、柴油、酒精都是碳氢化合物,都可作燃料
难度: 简单查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
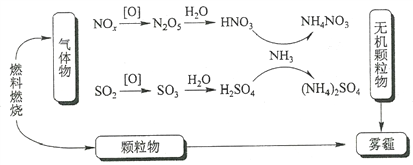
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
难度: 简单查看答案及解析
-
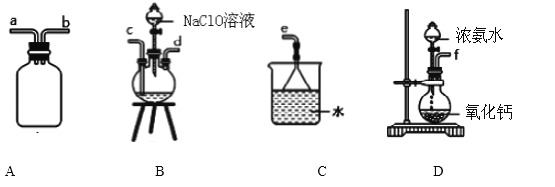
下列实验及其结论都正确的是
实验
结论
A
氯气的水溶液可以导电
氯气是电解质
B
铝箔在酒精灯火焰上加热熔化但不滴落
铝箔表面氧化铝熔点高于铝
C
将 Na2S 滴入 AgNO3 和 AgCl 的混合浊 液中产生黑色沉淀
Ksp(AgCl)>Ksp(Ag2S)
D
用分液漏斗分离苯和四氯化碳
四氯化碳密度比苯大
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是
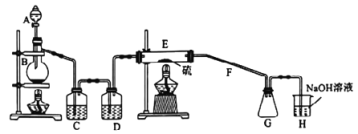
A. 实验时需先点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HCl
D. G中可收集到纯净的产品
难度: 困难查看答案及解析
-
短周期主族元素A、B、C、D的原子序数依次增大.甲、乙、丙、丁、戊是由这些元素组成的常见化合物,其中丙、丁、戊为二元化合物,已是元素C的单质。甲、乙的溶液均呈碱性。下列说法错误的是
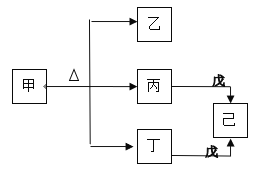
A. 甲和戊加入水中都能破坏水的电离平衡 B. 乙和戊都含有离子键
C. 原子半径r(D)>r(B)>r(C)>r(A) D. A、B、C形成的化合物一定显酸性
难度: 中等查看答案及解析
-
科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是( )
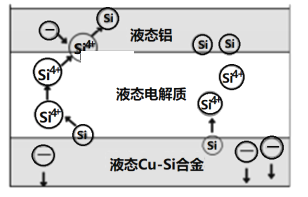
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先 于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
难度: 中等查看答案及解析
-
常温下向浓度均为0.10mol/L、体积均为1mL的NaOH溶液和Na2CO3溶液中分别加水,均稀释至VmL,两种溶液的pH与lgV的变化关系如图所示.下列叙述中错误的是
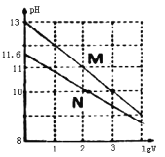
A. Khl(CO32-)(Khl为第一级水解平衡常数)的数量级为10-4
B. 曲线N表示Na2CO3溶液的pH随lgV的变化关系
C. Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D. 若将Na2CO3溶液加热蒸干,由于CO32-水解,最终析出的是NaOH固体
难度: 中等查看答案及解析