-
用物理方法可以从海水中提取的物质是
A. 食盐 B. 金属镁 C. 溴单质 D. 单质钠
难度: 简单查看答案及解析
-
下列物质中,属于非电解质的是
A. 纯碱 B. 蔗糖 C. 硫酸 D. 醋酸
难度: 简单查看答案及解析
-
当光束通过下列分散系:①有尘埃的空气 ②鸡蛋清 ③冰水混合物 ④氢氧化铁胶体,能观察到丁达尔效应的是
A. ①②④ B. ①②③ C. ②③④ D. ①③④
难度: 简单查看答案及解析
-
下列问题与氮的氧化物的排放无关的是
A. 酸雨 B. 温室效应
C. 光化学烟雾 D. 臭氧空洞
难度: 简单查看答案及解析
-
下列变化中,需要加入适当的还原剂才能完成的是
A. FeCl3→FeCl2 B. Cu→Cu2(OH)2CO3
C. SO3→H2SO4 D. HCl→Cl2
难度: 简单查看答案及解析
-
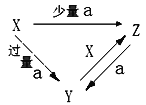
同温同压下,在两个容积相同的容器中,一个盛有CO2气体,另一个盛有N2和CO的混合气体。两容器内的气体一定具有相同的
A. 原子数 B. 密度 C. 质量 D. 分子数
难度: 中等查看答案及解析
-
《本草纲目拾遗》中在药物名“鼻冲水”条目下写到:“贮以玻璃瓶,紧塞其口,勿使漏气,则药力不减。气甚辛烈,触人脑,非有病不可嗅”;在“刀创水”条目下写到:“治金创,此水涂伤口,好敛合如故”。这里所说的“鼻冲水”“刀创水”分别指的是
A. 氢氟酸、食盐水 B. 食醋、石灰水 C. 氨水、碘酒 D. 稀硫酸、稀硝酸
难度: 简单查看答案及解析
-
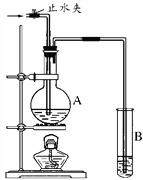
在实验室里按如图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
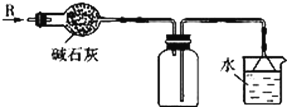
A. H2 B. NH3 C. Cl2 D. HCl
难度: 中等查看答案及解析
-
下列关于试剂保存的说法中错误的是
A. 浓硝酸保存在棕色试剂瓶中,放阴凉冷暗处
B. 液溴保存在棕色磨口试剂瓶中,并加入少量水密封保存
C. 烧碱溶液保存在用玻璃塞的玻璃试剂瓶中
D. 氢氟酸保存在抗酸塑料瓶中
难度: 简单查看答案及解析
-
向100 mL 18 mol•L-1的H2SO4溶液中加入足量的铜片并加热,充分反应后,生成SO2气体的物质的量为
A. 小于0.90 mol B. 0.90 mol
C. 1.80 mol D. 大于0.90 mol小于1.80 mol
难度: 中等查看答案及解析
-
对下列事实的解释错误的是
A. 氨气极易溶于水,氨气能够做“喷泉”实验
B. 常温下,浓硝酸可用铝罐来贮存,说明常温下浓硝酸不与铝发生反应
C. 向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性
D. 氯气不能使干的有色布条褪色,能使湿润的有色布条褪色,说明次氯酸具有漂白性
难度: 中等查看答案及解析
-
下列有关实验的描述中,错误的是
A. 钠在氧气或氯气中燃烧,都能观察到黄色火焰
B. 钠放入水中后,沉在水下缓缓冒出气体
C. 为了检验某FeCl2溶液是否变质,可取少量溶液加入KSCN溶液观察是否变红
D. 向某溶液中加入烧碱溶液,加热后生成使湿润红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
难度: 中等查看答案及解析
-
下列关于铜及其化合物的说法中不正确的是
A. 高温下黑色的氧化铜转化为红色氧化亚铜,说明氧化亚铜热稳定性强于氧化铜
B. 铜在干燥的空气中性质稳定,但在潮湿的空气中易被腐蚀,生成铜绿
C. 无水硫酸铜可用来检验水蒸气的存在
D. 铜与氯气、氧气和硫分别反应,得到产物中铜的化合价均为+2价
难度: 中等查看答案及解析
-
下列实验装置不能达到实验目的的是
A.
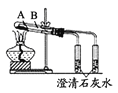 判定碳酸钠比碳酸氢钠稳定性 B.
判定碳酸钠比碳酸氢钠稳定性 B. 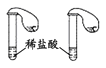 鉴别碳酸钠和碳酸氢钠
鉴别碳酸钠和碳酸氢钠C.
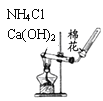 实验室制取氨气 D.
实验室制取氨气 D. 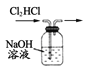 除去氯气中的氯化氢
除去氯气中的氯化氢难度: 中等查看答案及解析
-
下列实验结果与图像不相符的是
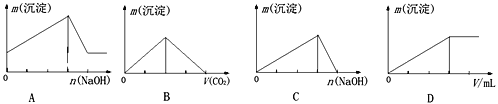
A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是
A. 铁片投入稀硫酸中2Fe+6H+ = 2Fe 3++3H2↑
B. 食醋与氨水反应:NH3·H2O+H+= NH4++H2O
C. 过量铁粉与稀硝酸反应:3Fe+8H++2NO3-= 3Fe 2++2NO↑+4H2O
D. 向Ba(OH)2溶液滴加NaHSO4溶液至Ba2+恰好沉淀:Ba2++2H++2OH-+SO42- = BaSO4↓+2H2O
难度: 简单查看答案及解析
-
下列关于金属及其化合物的说法中正确的是
A. 氧化钠和过氧化钠都属于碱性氧化物
B. 豆粒大的金属钠投入到硫酸铜溶液中,析出红色的固体物质
C. 金属钠、镁着火时,可用“干冰”进行灭火
D. 运用铝热反应原理可以冶炼金属铬、锰等难熔金属
难度: 中等查看答案及解析
-
某溶液中有Mg2+、Fe2+、Al3+、Cu2+4种离子,若向其中加入过量的Na2O2固体,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A. Cu2+ B. Mg2+ C. Fe2+ D. Al3+
难度: 中等查看答案及解析