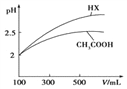
-
下列混合溶液中,离子的浓度大小顺序正确的是( )
A. 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. 10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10mL0.1mol/L醋酸与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D. 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
化学与生产、生活息息相关,下列叙述错误的是( )
A.碱性锌锰干电池比普通锌锰干电池性能好,比能量和可储存时间均有提高
B.汽车加大油门、把食物放在冰箱里,食品包装袋内放置小包除氧剂,都是为了改变反应物转化率而采取的措施
C.1kg人体脂肪可存储约32200kJ能量,一般人每行走1km大约要消耗170kg能量,如果每天步行5kg,一年(按365天计)中消耗的脂肪大约是9.6kg
D.炒菜用铁锅未及时洗净(残余中含NaCl),可能发生电化学腐蚀生成红褪色锈斑
难度: 简单查看答案及解析
-
下列各组变化中,化学反应的反应热前者大于后者的一组是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1;
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;
②2H2(g)+O2(g)=2H2O(l)△H1;
H2(g)+½O2(g)=H2O(l)△H2
③t℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g)△H1;
CaO(s)+H2O(l)=Ca(OH)2(s)△H2
A. ③④ B. ②③ C. ①② D. ①④
难度: 中等查看答案及解析
-
下列变化过程,属于吸热反应的是( )
①铝热反应 ②酸碱中和 ③浓H2SO4稀释 ④固体氢氧化钠溶于水
⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)2•8H2O混合搅拌 ⑧工业制取水煤气.
A. ①②③④⑤ B. ①②⑤ C. ⑦⑧ D. ⑥⑦⑧
难度: 简单查看答案及解析
-
下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)==CO2(g)+2H2O(g)△H=-890.3kJ/mol
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g)△H=-38.6kJ/mol
C.NaOH(s)+1/2 H2SO4(浓)==1/2Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
D.2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)△H=-2589.6kJ/moL
难度: 中等查看答案及解析
-
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是( )
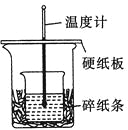
A. 如图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填碎纸条的主要作用是固定小烧杯
D. 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
难度: 简单查看答案及解析
-
已知热化学方程式:
① C2H2(g) +5/2O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+
O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) == C2H2(g)的△H为( )
A. +228.2 kJ·mol-1 B. -228.2 kJ·mol-1
C. +1301.0 kJ·mol-1 D. +621.7 kJ·mol-1
难度: 简单查看答案及解析
-
有关键能(破坏1mol共价键吸收的能量)数据如表
化学键
Si-O
O=O
Si-Si
键能/kJ•mol-1
X
498.8
176
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2kJ•mol-1,则X的值为( )
(已知1molSi中含有2molSi-Si键,1molSiO2中含有4molSi-O键)
A. 460 B. 423.3 C. 832 D. 920
难度: 简单查看答案及解析
-
将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法:
①用物质A表示的反应的平均速率为0.3 mol/L•s
②用物质B表示的反应的平均速率为0.6 mol/L•s
③2s时物质A的转化率为70%
④2s时B物质的浓度为0.7 mol/L
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
难度: 简单查看答案及解析
-
下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
难度: 中等查看答案及解析
-
有一反应:2A+B
2C,其中A、B、C均为气体,右图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是:
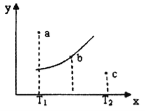
A. 该反应是放热反应
B. b点时混合气体的平均摩尔质量不再变化
C. T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D. c点可表示v(正)<v(逆)
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A. 向盐酸中加入氨水至中性,溶液中
B. 在蒸馏水中滴加浓H2SO4,Kw不变
C. 向0.1mol/L CH3COOH溶液中加入少量水,溶液中
增大
D. 将CH3COONa溶液从20℃升温至30℃,溶液中
增大
难度: 中等查看答案及解析
-
从植物花中可提取一种简写为HIn的有机物,在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。
HIn(aq,红色) H++In-(aq,黄色),在浓度为0.02 mol•L-1的下列各溶液(1)HCl、(2)Na2O2、(3)NaCl(aq)、(4)NaHSO4(aq)、(5)NaHCO3(aq)、(6)氨水中加入该指示剂,其中能使指示剂显红色的是( )
A. (1)(4)(5) B. (2)(6) C. (1)(4) D. (5)(6)
难度: 简单查看答案及解析
-
25℃,若PH=a的10体积某强酸溶液与PH=b的1体积某强碱溶液混合后溶液呈中性,则a和b应满足的关系为( )
A. a+b=14 B. a+b=13 C. a+b=17 D. a+b=15
难度: 中等查看答案及解析
-
下面的问题中,与盐类水解有关的是( )
①为保存FeCl2溶液,要在溶液中加入少量盐酸;
②实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡胶塞;
③在NH4Cl或AlCl3溶液中加入镁条会产生气泡;
④长期使用硫酸铵,土壤酸性增强.
A. 只有①④ B. 只有②③ C. 只有③④ D. 全部
难度: 中等查看答案及解析
-
物质的量浓度相同的下列各溶液,由水电离出的c(H+)由大到小的顺序是
①NaHSO4②NaHCO3③Na2CO3④Na2SO4
A. ④③②① B. ①②③④ C. ③②④① D. ③④②①
难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是()
A. 同浓度的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③
B. Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. 10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL
D. 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
难度: 困难查看答案及解析
-
25℃时,已知:Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是( )
A. 饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 在Mg(OH)2悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化为MgF2
C. 在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
D. Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/LNH4Cl溶液中的Ksp小
难度: 中等查看答案及解析
-
某原电池装置如图所示.下列有关叙述中,正确的是( )
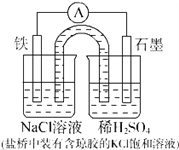
A. Fe作正极,发生氧化反应
B. 正极反应:2H++2e-=H2↑
C. 工作一段时间后,两烧杯中溶解pH均不变
D. 工作一段时间后,NaCl溶液中c(Cl-)减小
难度: 中等查看答案及解析
-
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极; ②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D
导线
C ; ③ A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡; ④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是 ( )
A. A> B > C > D B. A > C > D > B
C. C > A > D > B D. C > B > D > A
难度: 困难查看答案及解析
-
如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
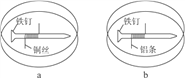
A. a中铁钉附近呈现红色 B. b中铁钉上发生还原反应
C. a中铜丝上发生氧化反应 D. b中铝条附近有气泡产生
难度: 中等查看答案及解析
-
用石墨作电极,电解1mol/L下列物质的溶液,溶液的PH值保持不变的是( )
A. HCl B. NaOH C. Na2SO4 D. NaCl
难度: 中等查看答案及解析
-
下列对如图所示装置实验现象的描述正确的是( )
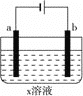
a电极
b电极
x溶液
实验现象
A
石墨
石墨
CuCl2
a极质量增加,b极放出无色气体
B
Fe
石墨
KNO3
a极质量增加,b极放出无色气体
C
Fe
Cu
CuSO4
a极质量增加,b极质量减少
D
石墨
石墨
HCl
a、b极都放出无色气体
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是2PbSO4+2H2O
PbO2+Pb+2H2SO4下列对铅蓄电池的说法错误的是( )
A. 需要定期补充硫酸
B. 工作时铅是负极,PbO2是正极
C. 工作时负极上发生的反应是Pb-2e-+SO42-===PbSO4
D. 工作时电解质的密度减小
难度: 中等查看答案及解析
-
由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是
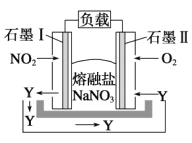
A. 石墨I极为正极,石墨II极为负极
B. Y的化学式可能为NO
C. 石墨I极的电极反应式为NO2+NO3--e-=N2O5
D. 石墨II极上发生氧化反应
难度: 困难查看答案及解析