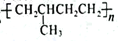-
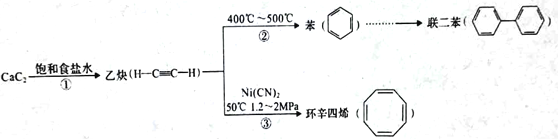
波义耳在《怀疑的化学家》一书中说:“在火的单独作用下,玻璃容器的水银会丧失其原有的银色,变成一种红色物体;而无须使用任何附加试剂,用这种红色物体也可以得到汞”。 该过程可表示为"2Hg+O2
 2HgO”下列说法错误的是
2HgO”下列说法错误的是A. 利用该反应可粗略测定空气中氧气的含量
B. 波义耳所描述的上述变化是一个可逆的化学反应
C. 水银温度计如果破损,可将硫粉洒在散落的水银上防止污染
D. 制备Hg单质可以采用热分解法使其氧化物在高温下分解制得
难度: 中等查看答案及解析
-
能将电能转化成化学能的是( )
A. 水力发电 B. 电瓶车开动 C. 手机充电 D. 风力发电
难度: 中等查看答案及解析
-
下列物质因水解而呈酸性的是( )
A. 浓硫酸 B. 酸雨 C. 氯化铵 D. 硫酸氢钠
难度: 中等查看答案及解析
-
下列反应属于氧化还原反应,且能量变化如下图所示的是
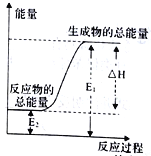
A. 锌粒和稀硫酸反应 B. 灼热的木炭与CO2反应
C. 甲烷在空气中燃烧的反应 D. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
常温下下列各组离子一定能在指定溶液中大量共存的是
A. 能使甲基橙变红的溶液中:Na+、Al3+、SO42-、Cl-
B. 与Al反应能放出H2的溶液中:Na+、Mg2+、NO3-、SO42-
C. 水电离出的c(H+)=10-10mol/L的溶液中:Na+、K+、Cl-、HCO3-
D. 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN-
难度: 中等查看答案及解析
-
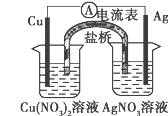
下列装置图中的实验方案能达到实验目的的是
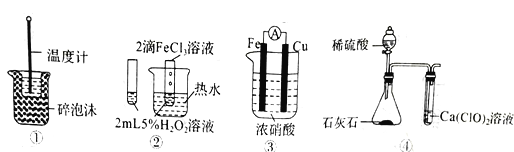
A. 图①可用于中和热的测定
B. 图②可验证FeCl3对H2O2分解反应有催化作用
C. 图③可用于探究铁作负极的原电池原理
D. 图④可用于验证酸性:H2SO4>H2CO3>HClO
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A. 已知C(石墨,s)=C( 金刚石,s) △H>0,则金刚石比石墨稳定
B. 己知2H2(g)+O2(g)=H2O(g) △H=-483.6k/mol,则氢气的燃烧热为241.8 kJ/mol
C. 已知2C(s)+202(g)=2CO2(g) △H1 2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H =-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
难度: 中等查看答案及解析
-
某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
A. 该反应在高温下才能自发进行
B. 再加入一定量CO2,则n(CH3OH)/n(CO2)减小
C. 温度升高,反应的平衡常数K增大
D. 当CO2和H2转化率相等时,该反应达到化学平衡
难度: 中等查看答案及解析
-
金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述中正确的是(已知氧化性: Fe2+<Ni2+<Cu2+)
A. 阳极发生还原反应,其电极反应式: Ni2++2e-=Ni
B. 电解后,Cu和Pt沉降在电解槽底部的阳极泥中
C. 电解后,溶液中存在的离子只有Fe2+和Zn2+
D. 电解过程中,阳极质量的减少与阴极质量的增加相等
难度: 中等查看答案及解析
-
25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
难度: 困难查看答案及解析
-
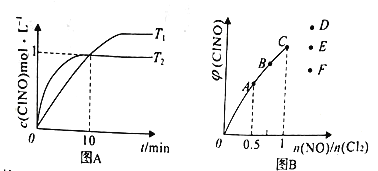
丁烯是一种重要的化工原料,可由丁烷催化脱氢制备,正丁烷(C4H10)催化脱氢制1-丁烯(C4H8) 的化学方程式如下:C4H10(g)=C4H8(g)+ H2(g) △H,如图是该反应平衡转化率与反应温度及压强的关系图,下列说法正确的是
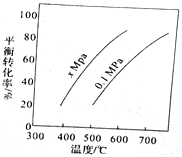
A. x>0.1
B. △H>O
C. 500C时,压强xMPa比0.1MPa条件下的平衡常数大
D. 一定温度下,在一恒容密闭容器中发生该反应,C4H10的浓度越高,平衡转化率越大
难度: 中等查看答案及解析
-
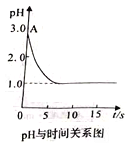
电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH 溶液分别滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
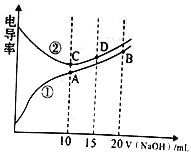
A. 曲线①代表滴定HCl溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)+c(H+)=0.1mol/L
C. 在相同温度下,A、B、C 三点溶液中水的电离程度: C<B<A
D. D点溶液中:2c(Na+)=3c(Cl-)
难度: 中等查看答案及解析
-
A由Al2O3、Fe2O3、Al、Cu中的某几种粉木混合而成,设计成份分析实验方案如下,下列分析不正确的是

A. 当m1>m2时,固体中一定存在A1元素
B. 生成蓝色溶液的离子方程式: Cu+2Fe3+=Cu2++2Fe2+
C. 当m2-m3=2.96g,Fe3O4的质量至少为2.32g
D. 溶液a中一定存在c(Na+)>c(A102-)>c(OH-)>c(H+)
难度: 中等查看答案及解析