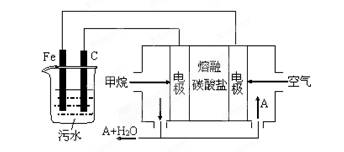
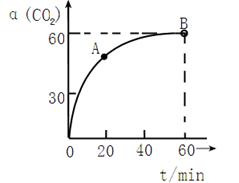
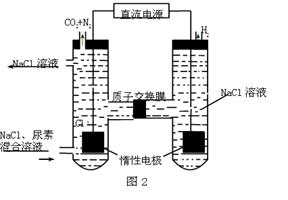
-
化学与生活紧密相连,对于日常生活中常见物质的成分描述说法正确的是:
A.食用白糖的主要成分是蔗糖 B.小苏打的主要成分是碳酸钠
C.煤气的主要成分是丁烷 D.植物油的主要成分是高级脂肪酸
难度: 简单查看答案及解析
-
某工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列物质中与该产品互为同分异构体的是:
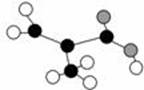
A.CH2=C(CH3)COOH B.CH2=CHCOOCH3
C.CH3CH2CH=CHCOOH D.CH3CH(CH3)COOH
难度: 简单查看答案及解析
-
氮化钠和氢化钠与水反应的化学方程式如下:
Na3N + 3H2O → 3NaOH + NH3, NaH + H2O → NaOH + H2↑
有关Na3N和NaH的叙述正确的是 :
A.离子半径:Na+>N3->H+ B.加热熔化时,都只破坏离子键
C.与盐酸反应都只生成一种盐 D.与水反应都是氧化还原反应
难度: 简单查看答案及解析
-
工业上将氨气和空气的混合气体通过铂铑合金网发生氨氧化反应,若有标准状况下 VL 氨气完全反应,并转移 n 个电子,则阿伏加德罗常数(NA)可表示为:
A. 11.2n/5V B. 5V/11.2n C. 22.4V/5n D. 22.4n/5v
难度: 简单查看答案及解析
-
已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是:

A.X可能是一种氢化物
B.若Y为单质,Y生成Z属于化合反应
C.E可能是一种有色气体
D.F中M元素的化合价可能为+5
难度: 简单查看答案及解析
-
下列解释实验现象的反应方程式正确的是:
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2 = Na2O2
B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgC1+S2- = Ag2S +2C1-
C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na2O2 + CO2= 2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:
2HCO3-+Ca2++2OH- = CaCO3↓+CO32-+2H2O
难度: 简单查看答案及解析
-
同时加热氯化镁晶体(MgCl2·6H2O)和硫酸镁晶体(MgSO4·7H2O)时,氯化镁易发生水解反应,其原因是:
A.氯化镁水解是熵增反应 B.硫酸镁晶体分解反应是放热反应
C.硫酸镁晶体分解反应是熵减反应 D.氯化镁分解放热比硫酸镁少
难度: 简单查看答案及解析
-
由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种或两种以上元素,它们分子中质子总数均与氩原子的质子数相同,已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是:
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期IV A族的元素,则丙一定是甲烷的同系物
D.丁和甲含有相同元素,且该元素在二者中的百分含量相同,则丁中一定含有-l价元素
难度: 简单查看答案及解析
-
某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是:
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ ②有胶状物质生成
③有气体产生 ④溶液颜色发生变化 ⑤共发生了2个氧化还原反应
A.①②③④ B.②③④ C.①③⑤ D.②④⑤
难度: 简单查看答案及解析
-
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为:
A.
B.
C.
D.
难度: 简单查看答案及解析
-
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断下列说法正确的是
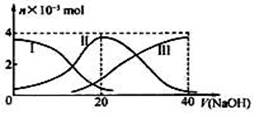
A.当y(NaOH)=20 mL时,溶液中离子浓度大小关系:
c(Na+) >c(HA一)>c(H+)> c(A2- )>c(OH—)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加入水的过程中,pH可能增大也可能减小
难度: 简单查看答案及解析
-
下列实验现象预测正确的是
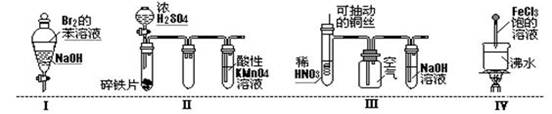 A.实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明
A.实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明B.实验Ⅱ:铁片最终完全溶解,且高锰酸钾溶液变无色
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:当溶液至红褐色,停止加热,让光束通过体系时可产生丁达尔现象
难度: 简单查看答案及解析
-
在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g)
2c(g) △H1<0; x(g)+3y(g)
2z (g) △H2>0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是:
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
难度: 简单查看答案及解析
-
已知25℃时,Mg(OH)2的Ksp = 5.6×10-12,MgF2的Ksp = 7.4×10-11。下列说法正确的是:
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大
C.25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp 比较,前者小
D.25℃时,在Mg(OH)2的悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化成MgF2
难度: 简单查看答案及解析
-
下列有关金属的工业制法中,正确的是:
A.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B.制铁:以铁矿石为原料,CO还原得铁
C.制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁
D.制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝
难度: 简单查看答案及解析
-
向10mL 0.1mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是:
A.x=10时,溶液中有
、
、
,且
B.x=10时,溶液中有
、
、
,且
C.x=30时,溶液中有
、
、
,且
D.x=30时,溶液中有
、
、
,且
难度: 简单查看答案及解析
-
下列表格中的各种情况,可以用下图的曲线表示的是
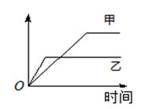
反 应
纵坐标
甲
乙
A
相同质量的氨,在同一容器中
2NH3
N2 + 3H2
氨气的转化率
500℃
400℃
B
等质量钾、钠分别与足量水反应
H2质量
钠
钾
C
在体积可变的恒压容器中,体积比1︰3的N2、H2,
N2 + 3H2
2NH3
氨气的浓度
活性高的催化剂
活性一般的催化剂
D
2 molSO2和1 molO2,在相同温度下2SO2 + O2
2SO3
SO3物质的量
2个大气压
10个大气压
难度: 简单查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是:
A.Cu与Cu2O 的物质的量之比为2:1 B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下体积为4.48L D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 简单查看答案及解析
-
图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R﹤W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 简单查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KA1O2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:

难度: 简单查看答案及解析