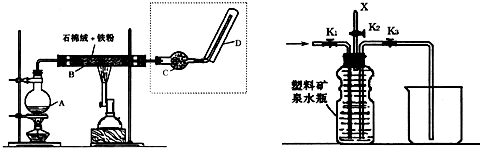
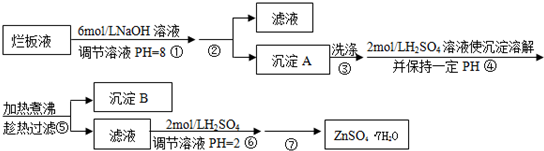
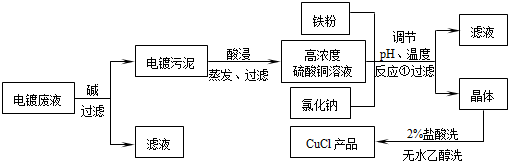
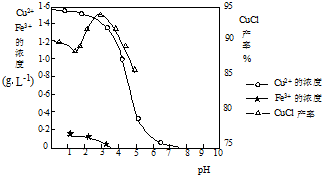
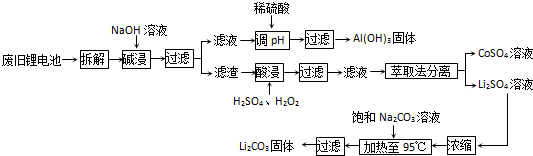
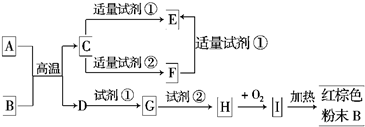
-
向含有1mol KAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使SO42-恰好转化为沉淀,此时生成的Al(OH)3的物质的量是( )
A.1mol
B.1.33mol
C.0.67mol
D.0难度: 中等查看答案及解析
-
关于合金性质的说法中,错误的是( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的物理性质不同
D.合金的化学性质一般与其各成分金属的化学性质不同难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.钾跟水的反应:2K+2H2O=2K++2OH-+H2↑
B.碳酸氢钠溶液和苛性钠溶液反应:H++OH-=H2O
C.过氧化钠加水:Na2O2+H2O=2Na++2OH-+O2↑
D.小苏打和少量澄清石灰水混合:Ca2++OH-+HCO3-=CaCO3↓+H2O难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
B.含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.能使加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3-
D.在AlCl3溶液中:K+、Na+、SiO32-、SO42-难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒
B.标准状况下,1.12 L的HCHO所含的原子数是0.2NA
C.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
D.16.9 g 过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA难度: 中等查看答案及解析
-
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3
B.Na2O2 Na2CO3
C.NaOH Na2CO3
D.Na2O2 NaOH Na2CO3难度: 中等查看答案及解析
-
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为2:1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A.1:10
B.1:8
C.1:6
D.1:5难度: 中等查看答案及解析
-
将等物质的量的镁和铝均匀混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3mol•LHCl溶液
B.4mol•LHNO3溶液
C.5mol•LNaOH溶液
D.18.4mol/LH2SO4溶液难度: 中等查看答案及解析
-
在我国近年来报道的高温超导体中,铊(Tl)是组成成分之一.已知铊和铝是同族元素,关于铊的性质的推断可能错误的是( )
A.是银白色的软质金属
B.能生成+3价的离子化合物
C.与硝酸作用能放出氢气并生成硝酸盐
D.铊的金属性强于铝难度: 中等查看答案及解析
-
要证明某溶液中不含Fe3+而可能含有Fe2+.进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液.
A.③①
B.③②
C.①③
D.①②③难度: 中等查看答案及解析
-
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③少量电石投入过量NaHCO3溶液 ④Na2O2投入FeCl2溶液.
A.①
B.③
C.②③
D.①③④难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.用氢氧化钠溶液出去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O
B.用浓盐酸与MnO2反应制取少量氯气:
C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
D.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-Fe3O4+S4O62-+2H2O,下列说法中,正确的是( )
A.每生成1 mol Fe3O4,反应转移的电子总数为4 mol
B.Fe2+和S2O32-都是还原剂
C.1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为mol
D.x=2难度: 中等查看答案及解析
-
向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S.T.P)的气体.所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为( )
A.68.6%
B.77.8%
C.81.4%
D.无法计算难度: 中等查看答案及解析