-
2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A.单质钠的密度比钾的密度小
B.Na+和K+常用作氧化剂
C.钠和钾都是短周期元素
D.钠和钾的合金[ω(K)=50%~80%]在室温下呈液态
难度: 中等查看答案及解析
-
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O则该反应中化合价发生变化和未发生变化的N原子数之比为
A.1:4 B.1:2 C.2:1 D.4:1
难度: 中等查看答案及解析
-
某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-⑤可能含有NH4+
A.①③⑤ B.①②③ C.③④⑤ D.②③④
难度: 中等查看答案及解析
-
两种微粒含有相同的质子数和电子数,这两种微粒可能是①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子;④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子;⑦两种不同阳离子;⑧两种不同阴离子;⑨一种阴离子和一种阳离子
A.①③⑤⑥⑦⑧ B.①③⑤⑦⑧ C.①③④⑤⑦ D.全部都是
难度: 中等查看答案及解析
-
氰气:(CN)2,结构:N≡C-C≡N;化学性质与卤素单质相似,下列叙述中正确的是
A.(CN)2分子中C—C键的键长小于F—F键的键长
B.氰化钠和氰化银均不溶于水
C.(CN)2不可以和不饱和烃起加成反应
D.(CN)2和NaOH溶液反应可生成NaCN、NaOCN和H2O
难度: 中等查看答案及解析
-
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI
CeI4 + 2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ = Ce3+ + 2Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.铈的四种核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同素异形体
难度: 中等查看答案及解析
-
周期表中有些元素有“对角线相似”现象,如Li、Mg;Be、Al;B、Si等两两性质相似。若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。下列说法正确的是
A.LiOH易溶于水 B.电解前LiCl在加热时已发生水解
C.无色气体为电解生成的H2 D.Li和水反应要比Na和水剧烈
难度: 中等查看答案及解析
-
已知OCN-中每种元素原子都满足8电子稳定结构,反应OCN-+OH-+C12→CO2+N2+C1-+H2O(未配平)中,如果有9 mol C12完全反应,则被氧化的OCN-的物质的量为
A.2mol B.3mol C.4mol D.6mol
难度: 中等查看答案及解析
-
在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80 mL浓度为0.5mol·L-1的HCl溶液中和,则生成物的成分是
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
难度: 中等查看答案及解析
-
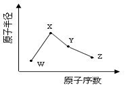
短周期元素X、Y的原子序数相差2。下列有关叙述正确的是
A.X与Y不可能位于同一主族 B.X与Y一定位于同一周期
C.X与Y不可能形成XY2型化合物 D.X与Y可能形成XY型或XY2型化合物
难度: 中等查看答案及解析
-
下列说法在一定条件下可以实现的是①酸性氧化物与碱发生反应;②弱酸与盐溶液反应可以生成强酸;③没有水生成,也没有沉淀和气体生成的复分解反应;④两种酸溶液充分反应后的溶液体系为中性;⑤有单质参加的非氧化还原反应;⑥两种氧化物反应的产物有气体
A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
难度: 中等查看答案及解析
-
如图所示,止水夹开始时处于关闭状态,将液体A滴入试管2中与气体B充分反应,打开止水夹,可发现试管1内的水立刻沸腾了。则液体A和气体B的组合不可能的是
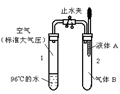
A.氧氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化碳
D.水、二氧化氮
难度: 中等查看答案及解析
-
以下反应可以类推的是
①由2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl类推
2FeCl3 + 3Na2S + 6H2O = 2Fe(OH)3↓ + 3H2S↑ + 6NaCl
②由Ca(HCO3)2 +2NaOH(过量) = CaCO3↓+ Na2CO3+ 2H2O类推
Mg (HCO3)2 +2NaOH(过量) = MgCO3↓+ Na2CO3+ 2H2O
③由NH4Cl
NH3 + HCl类推NH4NO3
NH3 + HNO3
④由Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO类推
2C6H5ONa + CO2 + H2O =Na2CO3↓ + 2C6H5OH
A.②和③ B.仅有③ C.仅有④ D.以上都错
难度: 中等查看答案及解析
-
下列说法不正确的是
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同
A.③④⑦⑧ B.①③④⑦⑧ C.①②⑤⑥⑨ D.①④⑦⑨
难度: 中等查看答案及解析
-
工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用相同条件下的NH3 3L恰好反应完全,则混合气中NO与NO2的体积分数比
A.l:4 B.1:3 C.l:2 D.l:l
难度: 中等查看答案及解析
-
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性溶液中可以产生Cl2,下列关于混盐CaOCl2的有关判断不正确的是(NA为阿伏加德罗常数)
A.该混盐在酸性溶液中产生1mol Cl2时转移的电子数为NA
B.该混盐的水溶液显碱性
C.该混盐中氯元素的化合价为+1和-1价
D.该混盐具有较强的还原性
难度: 中等查看答案及解析
-
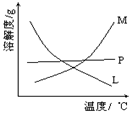
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法不正确的是
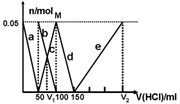
A.M点时生成的CO2为0mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a曲线表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓
难度: 中等查看答案及解析
-
一定量的铝铁合金与300 mL 2 mol/L的硝酸反应生成3.36 L NO(标准状况)和3价铁盐、铝盐等,再向反应后的溶液中加入3 mol/L NaOH溶液,使铝铁元素刚好全部转化为沉淀,则所加NaOH的体积为
A.100 mL B.150 mL C.450 mL D.无法计算
难度: 中等查看答案及解析
-
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3 。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物的质量为n(2-x)mol
B.处理废水中Cr2O72- 的物质量为
mol
C.反应中发生转移的电子数为3nx mol
D.在FeO·FeyCrxO3中3x=y
难度: 中等查看答案及解析
-
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断错误的是
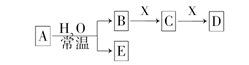
A.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E是一种清洁的能源
B.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
C.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
D.若X是Na2CO3,C为含极性键的分子,则A一定是氯气,且D和E能发生反应
难度: 中等查看答案及解析