-
下列叙述正确的是( )
A. 浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
B. 我国预计2020年发射首颗火星探测器,其太阳能电池帆板的材料是晶体硅
C. “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
D. “一带一路”是现代“丝绸之路”,丝绸的主要成分是纤维素
难度: 简单查看答案及解析
-
下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2 、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既为氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电镀、电化学腐蚀
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铝生成
⑦苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
⑧金属元素和非金属元素形成的化合物一定是离子化合物
A.3个 B.4个 C.5个 D.6个
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 硅晶体中,有NA个Si就有2 NA个Si—Si键
B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
C. 惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L
D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA
难度: 困难查看答案及解析
-
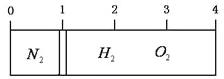
一定温度和压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
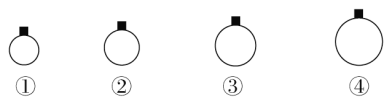
A. 气球②中装的是O2
B. 气球①和气球③中气体分子数相等
C. 气球①和气球④中气体物质的量之比为4∶1
D. 气球③和气球④中气体密度之比为2∶1
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 含大量Fe3+的溶液中: Na+、Mg2+、SO42-、SCN-
B.
=106的溶液中: NH4+、K+、AlO2-、NO3-
C. 能使甲基橙变红的溶液中: Cu2+、 Mg2+、SO42-、Cl-
D. 1.0 mol·L-1的KNO3溶液中:Fe2+、H+、Cl-、I-
难度: 中等查看答案及解析
-
为达到预期的实验目的,下列操作正确的是
A. 欲配制质量分数为10%的ZnSO4溶液,将l0 g ZnSO4·7H2O溶解在90 g水中
B. 欲制备F(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C. 为鉴别KCl、AICl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D. 为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
难度: 中等查看答案及解析
-
根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作
现象
实验结论
A
用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中
出现白色沉淀
H2CO3的酸性比H2SiO3的酸性强
B
向某溶液先滴加硝酸酸化,再滴加BaCl2溶液
出现白色沉淀
原溶液中含有SO42-、SO32-、HSO3-中的一种或几种
C
将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中
Cu片表面产生大量气泡
金属性:Zn>Cu
D

左边棉球变为橙色,右边棉球变为蓝色
氧化性:Cl2>Br2>I2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是( )
A. 少量SO2通入Ca (ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
B. Fe(NO3)3溶液中加入过量的HI溶液2Fe3++2I-=2Fe2++I2
C. NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D. NaHCO3溶液加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析
-
将过量H2O2溶液加入含(NH4)2CrO4 的氨水中,加热后冷却,生成暗棕红色晶体M[化学式为Cr(NH3)3O4],其离子方程式为:CrO42-+3NH3+3H2O2=M+2H2O+2OH-+O2↑,测得M中有2个过氧键。下列叙述正确的是
A. M中Cr的化合价为+3
B. 参与反应的H2O2全部被氧化
C. 向FeSO4溶液中滴加几滴M的溶液,没有明显现象
D. 转移0.2mol电子时,生成M的质量为16.7g
难度: 困难查看答案及解析
-
下列离子方程式的书写正确的是( )
A. 向Na2S2O3溶液中通入足量氯气:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
B. 向AlCl3溶液中加入足量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
D. 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
难度: 中等查看答案及解析
-
已知向溶液X中滴加溶液Y可生成两种沉淀,所得沉淀的物质的量(n)与所加入的溶液Y的体积(V)的关系如图所示,则X、Y分别为( )
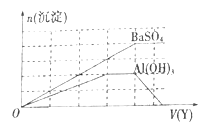
A
B
C
D
X
NH4Al(SO4)2
Ba(OH)2
明矾
Ba(AlO2)2
Y
Ba(OH)2
明矾
Ba(OH)2
硫酸铝
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验。则下列判断正确的是

A. 气体甲一定是纯净物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO2-和SiO32-一定存在于溶液X中
D. CO32-和SO42-一定不存在于溶液X中
难度: 中等查看答案及解析
-
制备新型高效水处理剂高铁酸钠(Na2FeO4)的主要反应为:2FeSO4+aNa2O2=2Na2FeO4+2Na2O+2Na2SO4+bX。下列说法中正确的是
A. 该反应中X物质为O2
B. 反应物Na2O2只作氧化剂
C. 该反应中发生氧化反应的过程只有FeSO4→Na2FeO4
D. 每生成l molNa2FeO4,反应过程中转移4 mol e-
难度: 困难查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题。下列化学反应先后顺序判断正确的是
A. 在含有等物质的量的A1O2-、OH-、CO32-溶液中逐滴加入盐酸: OH-、CO32-、A1O2-
B. 在含等物质的量的FeBr2、FeI2溶液中缓慢通人氯气: I-、Br-、Fe2+
C. Fe(NO3)3、Cu(NO3)2、HNO3混合溶液中逐渐加入铁粉: Fe(NO3)3、HNO3、Cu(NO3)2
D. 在含等物质的量的Fe3+、NH4+、H+溶液中逐滴加入NaOH溶液: H+、Fe3+、NH4+
难度: 简单查看答案及解析