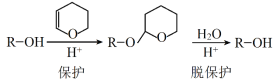
-
下列有关物质分类或归纳的说法中,正确的是( )
A. 纯碱、烧碱和氨水都属于碱
B. 碱石灰、铝热剂、盐酸都是混合物
C. CaO、K2O、Na2O2都是碱性氧化物
D. Al2O3、Na、CuSO4在熔融状态或溶于水时均能导电,都属于电解质
难度: 简单查看答案及解析
-
如图为雾霾的主要成分示意图。下列说法正确的是( )
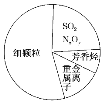
A. 雾能产生丁达尔效应,凡是直径在在1-100nm 之间的粒子都属于胶体
B. SO2能使酸性KMnO4溶液褪色,表现漂白性
C. 苯,二甲苯,硝基苯都是芳香烃
D. 汽车尾气的大量排放是造成雾霾天气的人为因素之一
难度: 简单查看答案及解析
-
下列过程属于化学变化的是( )
①白色的硫酸铜粉末久置于空气中变成蓝色 ②用福尔马林浸制标本 ③ 石油裂解
④同素异形体之间的互变 ⑤用汽油清除衣服上的油漆 ⑥核裂变 ⑦ 煤的干馏
⑧蜂蚁叮咬处涂稀氨水或小苏打溶液可减轻痛苦
A. 只有②③⑤⑦ B. 只有①②③④⑥ C. 只有①②③④⑦⑧ D. 全部
难度: 简单查看答案及解析
-
下列图示中实验基本操作正确的是( )
A
 B
B  C
C 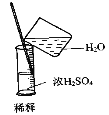 D
D
A. 除去CO的CO2 B. 萃取时振荡混合液 C. 稀释浓硫酸 D. 向试管中滴加液
难度: 简单查看答案及解析
-
相同状况下的12C18O和14N2两种气体,下列说法正确的是
A. 若分子数相等,则体积相等 B. 若原子数相等,则中子数相等
C. 若质量相等,则质子数相等 D. 若体积相等,则质量数相等
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的值。下列叙述正确的组合是( )
① 14 g乙烯和丙烯的混合物中氢原子数为2NA个
② 0.1mol·L-1 的FeCl3溶液滴入沸水形成的胶体粒子的数目为0.1NA个
③ 标准状况下,2.24L Cl2通入足量的NaOH溶液中转移的电子数为0.1 NA个
④ 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH- 数目为0.2NA个
⑤ 常温下,100mL 1mol·L-1 Na2CO3溶液中阴离子总数大于0.1 NA个
⑥ 1 mol Na2O2与足量水蒸气反应转移电子数为NA个
⑦0.2NA个CH4分子与足量氯气反应,生成物在标准状况下的体积为22.4L
A. ①④⑤⑥ B. ②⑤⑥⑦ C. ①③⑤⑥ D. ①③⑤⑦
难度: 中等查看答案及解析
-
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是( )
A. 猪油、麻和 蚕丝 ,纸张 都是天然高分子化合物
B. 检验淀粉在稀硫酸作用下水解是否完全可以冷却后取样直接滴入碘水
C. 糖类一定能发生银镜反应和水解反应
D. 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
难度: 中等查看答案及解析
-
98%的浓硫酸(密度为1.84 g·cm-3)配制0.5 mol·L-1的稀硫酸240 mL,现给出下仪器:①50 mL量筒;②10 mL量筒;③50 mL烧杯;④托盘天平 ⑤250 mL容量瓶;⑥胶头滴管;⑦玻璃棒。配置过程一定需要使用的仪器是( )
A. ②③⑤⑥⑦ B. ③④⑤⑥⑦ C. ①③⑤⑥⑦ D. ①③⑤⑥
难度: 简单查看答案及解析
-
对溶液物质的量浓度、质量分数概念的理解正确的是( )
A. 用100mL水吸收0.1molHCl气体所得溶液的物质的量浓度恰好是1mol·L-1
B. 1L水中溶解5.85gNaCl所形成的溶液的物质的量浓度是0.1mol·L-1
C. 将25gCuSO4·5H2O晶体溶于75g水中所得溶质的质量分数为25%
D. 将40gSO3溶于60g水中所得溶质的质量分数为49%
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A. 聚乙烯能使溴的四氯化碳溶液褪色
B. 用水可以分离苯和溴苯的混合物
C. 聚氯乙烯的单体是CH2=CHCl,该单体的某些化学性质与乙烯相似
D. 与H2加成反应生成异戊烷的物质一定是烯烃
难度: 中等查看答案及解析
-
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O===NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价) ( )
A. NaBH4既是氧化剂又是还原剂
B. 产生1molH2转移电子2mol
C. 硼元素被氧化,氢元素被还原
D. 氧化产物和还原产物物质的量之比为1∶1
难度: 中等查看答案及解析
-
如图所示进行电化学实验,电极材料为铜和另一电极X,则以下说法中错误的是( )

A. 铜电极上既可能发生反应:Cu-2e- =Cu2+,又可能发生 Cu2++2e- =Cu
B. 该装置既可实现化学能转化成电能,又能实现电能转化成化学能
C. X电极上既可能产生H2,又可能产生O2
D. 该装置既可做电镀铜的实验,又可以研究精炼铜的原理
难度: 中等查看答案及解析
-
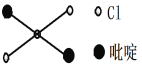
萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
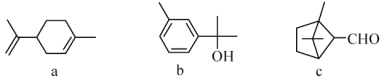
A. a和b都属于芳香族化合物
B. b的一氯代物有5种
C. a、b和c均能和氢气在一定条件下发生加成反应
D. a和c分子中所有碳原子均处于同一平面上
难度: 中等查看答案及解析
-
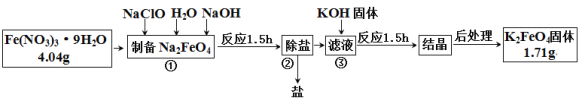
实验室提纯含少量氯化钠杂质的硝酸钾的过程如右图所示。下列分析正确的是

A. 操作Ⅰ是过滤,将固体分离除去 B. 操作Ⅱ是加热浓缩、趁热过滤,除去杂质氯化钠
C. 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 D. 操作Ⅰ~Ⅲ总共需两次过滤
难度: 中等查看答案及解析
-
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下图所示:
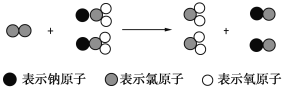
下列有关该反应的叙述中正确的是 ( )
A. 该反应是置换反应
B. 该反应的化学方程式为Cl2+NaClO2===ClO2+NaCl
C. 反应中Cl2既是氧化剂,又是还原剂
D. 氧化性: Cl2 > ClO2
难度: 中等查看答案及解析
-
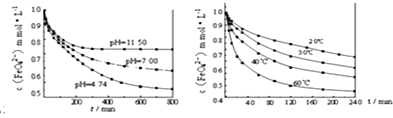
常温下,向浓度均为0.1 mol·L-1、体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是
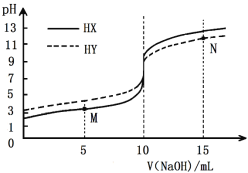
A. N点:c(Na+)=c(Y-)+c(HY)
B. M点:c(X-)>c(Na+)
C. 滴至pH=7时,消耗NaOH溶液的体积:HX>HY
D. 滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY
难度: 中等查看答案及解析