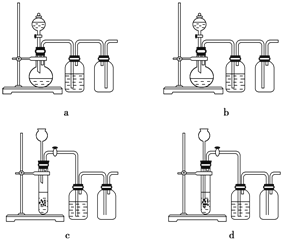
-
实验操作规范且能达到目的是( )
目的
操作
A.
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
B.
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C.
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D.
配制浓度为0.010mol/L的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在含有下列各离子组的溶液中,能大量共存且溶液为无色透明的是( )
A. Na+、Cu2+、Cl-、SO42― B. Ba2+、K+、OH-、NO3―
C. K+、Ca2+ 、NH4+、CO32― D. H+、Ca2+、Cl-、HCO3―
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A. X的简单氢化物的热稳定性比W的强
B. Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
C. Y的简单离子与X的具有相同的电子层结构
D. Z与X属于同一主族,与Y属于同一周期
难度: 困难查看答案及解析
-
下列物质中,属于酸性氧化物且易溶于水的是
A. NO B. SiO2 C. NO2 D. SO2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A. 1.8 g 18O2中含有NA个电子
B. 1L 0.1mol/L硅酸钠溶液中含有0.1 NA个SiO32—
C. 标准状况下,11.2LCO和NO混合气体中含0.5NA氧原子
D. 0.1mol 铁粉与足量的盐酸充分反应,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
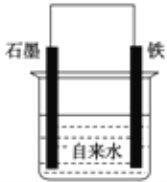
A. 正极的电极方程式为:O2+ 2H2O + 4e-═ 4OH-
B. 将石墨电极改成Mg电极,难以观察到铁锈生成
C. 若向自来水中加入少量NaCl(s),可较快地看到铁锈
D. 向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快
难度: 中等查看答案及解析
-
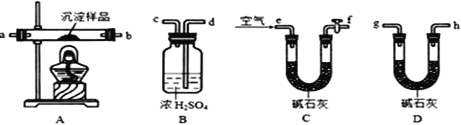
用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
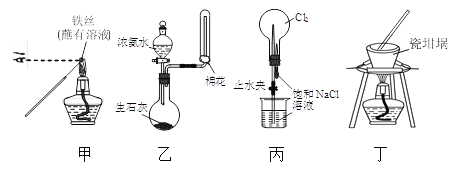
A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 钠与水反应:Na +2H2O=Na++2OH–+H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O
H2↑+Cl2↑+2OH–
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O
难度: 中等查看答案及解析
-
如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是
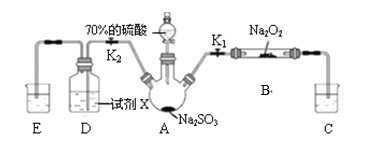
A. 为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
B. 关闭 K2,打开 K1,滴加硫酸,则装置 B 中每消耗1mol Na2O2,转移1mol电子
C. 关闭 K1,打开 K2,试剂 X 是酸性 KMnO4 或 FeCl3 溶液,均可证明 SO2 有还原性
D. 实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
难度: 中等查看答案及解析
-
一种钌(Ru)基配合物光敏染料敏化太阳能电池的工作原理及电池中发生的主要反应如图所示。下列说法错误的是
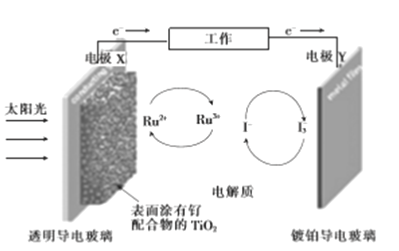
A. 电池工作时,光能转变为电能,X 为电池的负极
B. 镀铂导电玻璃上发生氧化反应生成I-
C. 电解质溶液中发生反应:2Ru3++3I-
2Ru2++I3-
D. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
难度: 中等查看答案及解析
-
(题文)下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
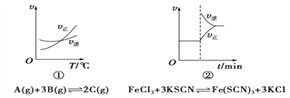
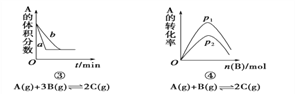
A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
难度: 困难查看答案及解析
-
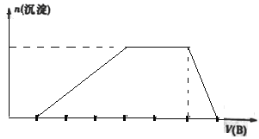
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
常温下向100mLFeCl3溶液中通入0.224L H2S,生成单质硫,再加入过量铁粉,反应停止后溶液中含有0.06mol阳离子。原FeCl3溶液的物质的量浓度是
A. 0.2 mol/L B. 0.3 mol/L C. 0.4 mol/L D. 0.6 mol/L
难度: 中等查看答案及解析
-
电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和 CH3COOH溶液。利用传感器测得滴定过程中溶液 的电导率如图所示。下列说法不正确的是

A. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)= 0.0500 mol·L-1
B. 曲线②代表滴定CH3COOH溶液的曲线
C. 在相同温度下,A、B、C三点溶液中水的电离程度: A>C>B
D. B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
难度: 中等查看答案及解析
-
己知A、B、C、D之间的置换转化关系如图所示、且A、D为单质。下列说法正确的是
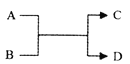
A. 若A为Fe,D为H2,则B一定为酸
B. 若A为非金属单质,则D 不一定为非金属单质
C. 若A为金属单质,D为非金属单质,则D一定是H2
D. 若A、D均为金属单质,则组成元素的金属性A必强于D
难度: 困难查看答案及解析
-
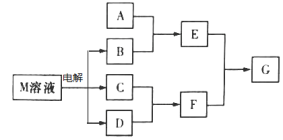
某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是
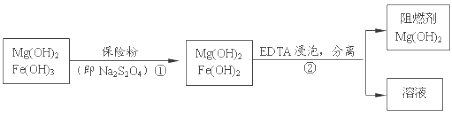
A. 步骤②中分离操作的名称是过滤,Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热
B. 步骤①中的反应式:3Fe(OH)3 +S2O42-+2OH- =3Fe(OH)2 +2SO42-+4H2O
C. 步骤①中保险粉是作还原剂
D. 从步骤② 中可知OH- 和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物
难度: 中等查看答案及解析