-
锂常用来制造高能量电池。已知锂的金属性介于钠和镁之间,则冶炼金属锂应采用的方法
A. 热还原法 B. 热分解法 C. 电解法 D. 铝热法
难度: 简单查看答案及解析
-
下列有关物质的性质或应用的说法不正确的是
A. 二氧化硅是生产光纤制品的基本原料
B. 水玻璃可用于生产黏合剂和防火剂
C. 盐析可提纯蛋白质并保持其生理活性
D. 石油分馏可获得乙烯、丙烯和丁二烯
难度: 简单查看答案及解析
-
.除去粗盐溶液中的Ca2+、Mg2+、SO42- 等杂质,需依次加入稍过量的NaOH溶液、X溶液、Y溶液,过滤,向滤液中滴加稀盐酸调至中性。其中X、Y分别是
A. Na2 CO3 Ba(NO3)2 B. Ba(NO3)2 Na2 CO3
C. Na2 CO3 BaCl2 D. BaCl2 Na2 CO3
难度: 简单查看答案及解析
-
化学与生活密切相关,下列说法正确的是( )
A. 铝制餐具不宜长时间存放酸性食物,但可以长时间存放碱性食物
B. 用汽油可以除去衣服上的油汤
C. 二氧化硫可以用于食品增白
D. 洁厕灵(含酸)与84消毒液混合施用
难度: 简单查看答案及解析
-
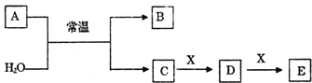
下列物质的每步转化在给定条件下能一步实现且较合理的是 ( )
A.

B.
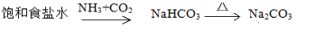
C.
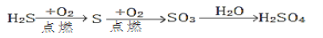
D.
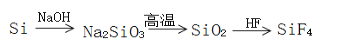
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 含4 mol Si-O键的石英晶体中,氧原子的数目为2NA
B. 100mL 12mol/L的浓盐酸与足量MnO2加热充分反应,生成的Cl2分子数为0.3NA
C. 2 L 1mol/L的盐酸中所含氯化氢分子数为2NA
D. 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数为0.1NA
难度: 中等查看答案及解析
-
下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
+2HCO3-→
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
难度: 简单查看答案及解析
-
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I−的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是
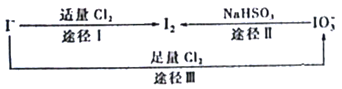
A. 向含I−的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3−
D. 一定条件下,I−与IO3−可能生成I2
难度: 中等查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的是( )
A.
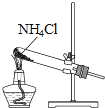 制取氨气 B.
制取氨气 B. 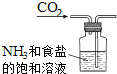 制取NaHCO3
制取NaHCO3C.
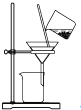 分离NaHCO3 D.
分离NaHCO3 D. 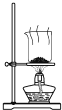 干燥NaHCO3
干燥NaHCO3难度: 简单查看答案及解析
-
某无色气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成为( )
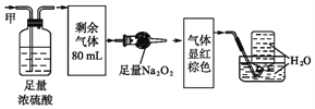
A. NH3、NO、CO2 B. NO、CO2、N2 C. NH3、NO2、CO2 D. NO、CO2、NO2
难度: 中等查看答案及解析
-
Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成BeO22—。现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是( )
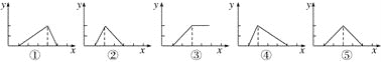
A. ⑤③① B. ②③④ C. ③⑤④ D. ③②①
难度: 中等查看答案及解析
-
某小组为探究草酸亚铁(FeC2O4)的热分解产物,按下面所示装置进行实验。以下说法错误的是
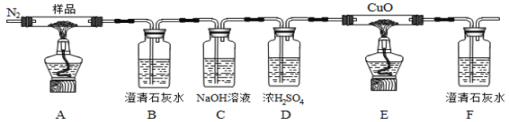
A. 实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO气体
B. 反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C. 装置C的作用是除去混合气中的CO2
D. 反应结束后,应熄灭A、E处酒精灯后,持续通入N2直至温度恢复至室温
难度: 困难查看答案及解析
-
向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2)
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C
0.015
c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D
0.03
c(Na+)> c(HCO3-)> c(OH-)>c(H+)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O
HClO + H++Cl-K2=10-3.4
HClO
H++ ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
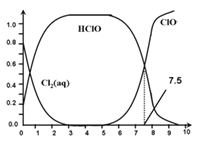
A. Cl2(g)+ H2O
2H++ ClO-+ Cl-K=10-10.9
B. 在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D. 氯处理饮用水时,在夏季的杀菌效果比在冬季差
难度: 中等查看答案及解析