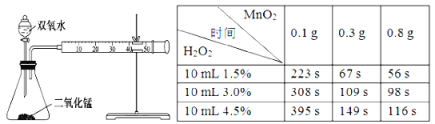
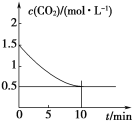
-
一定条件下的密闭容器中: 4NH3(g)+5O2(g)⇌ 4NO(g)+6H2O(g),△H=-905.9kJ·mol-1, 下列叙述正确的是
A. 4mol NH3和5mol O2反应, 达到平衡时放出热量为905.9kJ
B. 平衡时v正(O2)=v逆(NO)
C. 平衡后降低压强, 混合气体平均摩尔质量增大
D. 平衡后升高温度, 混合气体中NO含量降低
难度: 中等查看答案及解析
-
通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提髙生活质量。下列各图所示的措施中,是为了加快化学反应速率的是
A. 铁门表面喷漆
 B. 橡胶里价炭黑
B. 橡胶里价炭黑 C. 扇子扇煤炉子
D.
难度: 简单查看答案及解析
-
下列说法正确的是
A. 凡是放热反应都是自发的,因为吸热反应都是非自发的
B. 自发反应的熵一定增大,非自发反应的熵一定减小
C. 常温下,反应C(s)+CO2(g)
2CO(g)不能自发进行, 则该反应的ΔH>0
D. 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
难度: 简单查看答案及解析
-
下列指定溶液中,各组离子可能大量共存的是
A. 使石蕊变红的溶液中:Na+、Cl-、SO42-、AlO2-
B. 在中性溶液中:Na+、Al3+、Cl-、HCO3-
C. 常温下pH=13的溶液中:NH4+、Ca2+、NO3-、SO42-
D. 由水电离出的c(H+)=10-13 mol·L-1的溶液中:Mg2+、Cl-、K+、SO42-
难度: 中等查看答案及解析
-
对于一定条件下进行的化学反应:2SO2(g)+O2(g)
2SO3(g),改变下列条件,可以提高反应物中活化分子百分数的是( )
①增大压强 ②升高温度 ③加入催化剂 ④减小反应物浓度

A. ①② B. ①④ C. ①②③ D. ②③
难度: 中等查看答案及解析
-
25℃时,下列四种溶液中,由水电离生成的氢离子浓度之比
①pH=0的盐酸 ②0.1 mol/L的盐酸
③0.01 mol/L的NaOH溶液 ④pH=14的NaOH溶液
A. 1∶10∶100∶1 B. 1∶10-1∶10-12∶10-14
C. 14∶13∶12∶14 D. 14∶13∶2∶1
难度: 中等查看答案及解析
-
下列事实能说明影响化学反应速率的主要因素是反应物自身性质的是
A.Cu能与浓硝酸反应,但不能与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Fe与浓盐酸反应比与稀盐酸反应快
难度: 中等查看答案及解析
-
对于反应4A+2B
3C,下列说法中正确的是
A. 某温度时,化学反应速率无论用A. B. C中任何物质表示,其数值都相同
B. 其他条件不变时,降低温度,化学反应速率减小
C. 其他条件不变时,增大压强,化学反应速率一定加快
D. 若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
难度: 中等查看答案及解析
-
在一密闭容器中发生反应:2A(g)+2B(g)
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
A. 移走少量C B. 扩大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入“惰”气
难度: 简单查看答案及解析
-
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A. 加少量烧碱 B. 升高温度
C. 加少量冰醋酸 D. 加CH3COONa固体
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 新制的氯水在光照条件下颜色变浅
难度: 中等查看答案及解析
-
下列有关平衡常数的说法中,正确的是
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)
N2O4(g) ΔH<0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. 由化学平衡常数K可以推断一个可逆反应进行的程度
难度: 中等查看答案及解析
-
某温度下的密闭容器中发生如下反应:2M(g)+N(g)
2E(g)。若开始时只充入2 mol E(g),达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 mol N(g) 的混合气体,则达到化学平衡时M的转化率是
A. 20% B. 40%
C. 80% D. 60%
难度: 中等查看答案及解析
-
298 K时,各反应的平衡常数如下:①N2(g)+O2(g)
2NO(g) K=1×10-30;②2H2(g)+O2(g)
2H2O(g) K=2×1081;③2CO2(g)
2CO(g)+O2(g) K=4×10-92,则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是 ( )
A. ① B. ②
C. ③ D. 无法判断
难度: 简单查看答案及解析
-
现有下列两个图象:

下列反应中符合上述图象的是( )
A. N2(g)+3H2(g)
2NH3(g) ΔH<0
B. 2SO3(g)
2SO2(g)+O2(g) ΔH>0
C. 4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0
D. H2(g)+CO(g)
C(s)+H2O(g) ΔH>0
难度: 中等查看答案及解析
-
可逆反应m A(s)+n B(g)
e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是( )
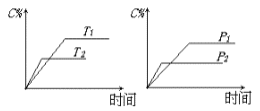
A. 达平衡后,加入催化剂则C%增大
B. 达平衡后,若升温,平衡左移
C. 化学方程式中n>e+f
D. 达平衡后,增加A的量有利于平衡向右移动
难度: 困难查看答案及解析
-
某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l)
2 CrO42-(aq)(黄色)+2H+(aq) ∆H=+13.8kJ·mol-1
步骤:
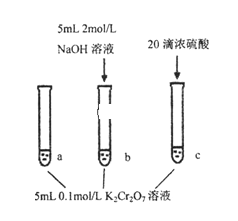
现象:
待试管b中颜色不变后与试管a比较,
溶液颜色变浅。
滴加浓硫酸,试管c温度略有升高,
溶液颜色与试管a相比,变深。
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
难度: 困难查看答案及解析
-
在密闭容器中发生如下反应:xA(g)+yB(g)
zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )
A、x+y﹥z B、平衡向右移动 C、B的转化率提高 D、C的体积分数降低
难度: 简单查看答案及解析
-
在恒容密闭容器中,将10 mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g)
COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
A. CO.H2S的转化率之比为1:1
B. 达平衡后H2S的体积分数为4%
C. 升高温度,COS浓度减小,表明该反应是吸热反应
D. 恒温下向平衡体系中再加入CO.H2S.COS.H2各1 mol,平衡不移动
难度: 困难查看答案及解析
-
一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应: CO(g)+Cl2(g)
COCl2(g)其中容器Ⅰ中5min 时到达平衡。
容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
CO
Cl2
COCl2
COCl2
Ⅰ
500
1.0
1.0
0
0.8
Ⅱ
500
1.0
a
0
0.5
Ⅲ
600
0.5
0.5
0.5
0.7
下列说法正确的是
A. 容器Ⅰ中前5min的中反应速率v(CO)=0.16mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55mol
D. 若起始时间容器Ⅰ中加入CO0.8mol、Cl2 0.8mol,达到平衡时CO的转化率大80%
难度: 中等查看答案及解析