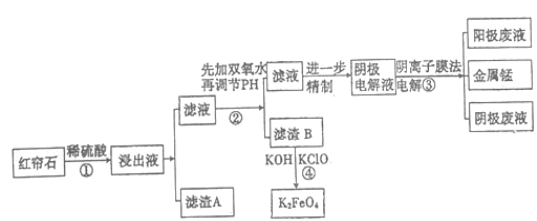
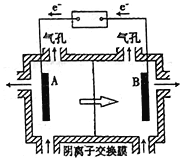
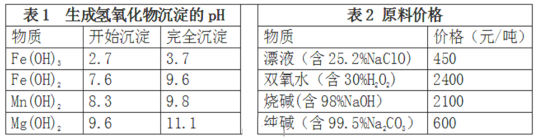
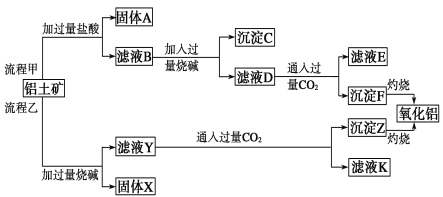
-
战国《周礼》冲记载“煤饼烧蛎房(即牡蛎壳)成灰”,并把这种灰称为“蜃”。蔡伦将此溶于水制得的碱液用于造纸术中沤浸树皮脱胶。该“蜃”的主要成分是
A. CaO B. Na2O C. Fe2O3 D. SiO2
难度: 中等查看答案及解析
-
下列各组物质之间的转化不是全部通过一步反应完成的是( )
A. Na→NaOH→Na2CO3→NaCl B. Mg→MgCl2→Mg(OH)2→MgSO4
C. Al→Al2O3→Al(OH)3→AlCl3 D. Fe→FeCl2→Fe(OH)2→Fe(OH)3
难度: 简单查看答案及解析
-
将金属与金属(或非金属)加热熔合在一起就能形成合金,根据下表中金属的熔点、沸点判断不能形成合金的是( )
Na
Cu
Al
Fe
熔点/℃
97.81
1 083
660
1 535
沸点/℃
882.9
2 595
2 467
3 000
A. Fe、Cu B. Al、Na C. Fe、Na D. Cu、Al
难度: 中等查看答案及解析
-
将Na、Mg、Al各0.3mol分别放入100mL 1mol/L的HCl中,同温同压下产生的气体的体积比是
A. 3:1:1 B. 6:3:2 C. 1:2:3 D. 1:1:1
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入到过量NaHCO3溶液中 ④向NaAlO2溶液中滴入少量盐酸 ⑤向饱和Na2CO3溶液中通入足量CO2
A. ①③④⑤ B. 只有①④ C. 只有②③ D. 只有③④⑤
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 镁铝合金的抗腐蚀能力强,不与稀硫酸反应
B. Na的金属活动性比Mg的强,故可用Na与MgCl2溶液反应制Mg
C. 钠可与冷水剧烈反应,而镁与热水才能反应,说明钠比镁活泼
D. Fe在Cl2中燃烧生成FeCl3,其中Fe显+3价,故Fe与其他非金属反应的产物中,Fe也显+3价
难度: 中等查看答案及解析
-
下列关于物质或离子检验的叙述正确的是
A. 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B. 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C. 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D. 分别向Na2CO3、NaHCO3溶液中加入澄清石灰水,溶液变浑浊的是Na2CO3
难度: 中等查看答案及解析
-
从金属利用的历史看,先是青铜器时代,而后是铁器时代,铝的冶炼是近百年的事,决定金属使用年代先后顺序的关键因素是( )
A. 金属的活动性 B. 金属的导电性
C. 金属的延展性 D. 地壳中金属元素的含量
难度: 简单查看答案及解析
-
过氧化钠跟足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却残留的固体物质是
A. Na2O2、Na2CO3 B. NaOH、Na2CO3
C. Na2CO3 D. Na2O2、NaOH、Na2CO3
难度: 困难查看答案及解析
-
下列说法正确的是
①新制氯水经光照一段时间pH减小
②Al和Fe都可以利用致密的氧化膜保护内层金属不被腐蚀
③Al2O3和Fe2O3都为碱性氧化物,所以都能溶于硫酸
④pH在5.6~7.0之间的降水通常称为酸雨
A. ①② B. ②③ C. ①③ D. ③④
难度: 简单查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象
结论
A
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体
HNO3分解生成了NO2
B
向NaAlO2溶液中滴加AlCl3溶液,无明显现象
NaAlO2与AlCl3不反应
C
将Na加入CuSO4溶液中,生成红色沉淀
Na与CuSO4发生置换反应
D
向饱和Na2CO3中通入足量CO2,溶液变浑浊
析出了NaHCO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是
A. 常温下,1 L 1 mol·L−1 Na2CO3溶液中,阴离子数目小于NA
B. 标准状况下,2 mol SO2和1 mol O2充分反应生成SO3的数目为2NA
C. 6.2 g Na2O和7.8 g Na2O2阴离子数目均为0.1 NA
D. 标准状况下,22.4 L Cl2完全参加反应,转移电子的数目一定为2NA
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 氢氧化亚铁在空气中的变化:2Fe(OH)2+O2+H2O=2Fe(OH)3
B. 硫酸亚铁溶液中加过氧化氢溶液:Fe2+ + 2H2O2 + 4H+=Fe3+ + 4H2O
C. 氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D. 硝酸铁溶液中加过量氨水:Fe3+ + 3NH3·H2O=Fe(OH)3 + 3NH4+
难度: 中等查看答案及解析
-
合金的应用极大地促进了人类社会的发展。下列不属于合金的是
A.青铜雁鱼灯
B.光导纤维
C. 航母甲板(钢)
D.潜水器外壳(钛、铝等)



A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.8mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A. 21.2g B. 6.2g C. 8.4g D. 10.6g
难度: 中等查看答案及解析
-
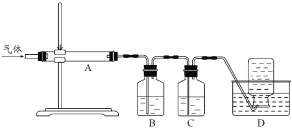
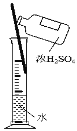
下列四组实验中,操作正确且能达到预期目的是
A. 配制稀硫酸
 B. 固体NaHCO3分解
B. 固体NaHCO3分解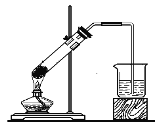
C. 制备Fe(OH)2沉淀
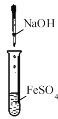 D. 收集NH3
D. 收集NH3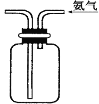
难度: 中等查看答案及解析
-
下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A. FeCl2 B. AlCl3 C. FeCl3 D. CuCl2
难度: 中等查看答案及解析
-
下列实验中的颜色变化,与氧化还原反应无关的是
选项
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
KSCN溶液滴入FeCl3溶液中
CO2通过装有Na2O2固体的干燥管
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
溶液变为红色
固体由淡黄色变为白色
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
将铜放入稀硫酸中,再加入下列一种试剂,常温下就可产生气体的是
A. FeCl3 B. KNO3 C. CuSO4. D. 浓H2SO4
难度: 中等查看答案及解析
-
将20g两种金属的混合物投入足量的稀硫酸中,反应完全后得到标准状况下H2 11.2L,则该混合物的组成可能是
A. Mg和Cu B. Na和Fe C. Al和Mg D. Zn和Fe
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 镁在空气中或纯净氧气中燃烧的产物都只有MgO
B. 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2
C. 将四氧化三铁溶解于过量的硝酸中,所得溶液中含有Fe3+、Fe2+
D. 氯化铝和过量的氨水反应一定得到Al(OH)3沉淀
难度: 中等查看答案及解析
-
已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
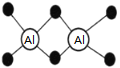
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
难度: 中等查看答案及解析
-
若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。

下列各表述与示意图一致的是
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图①中使用的NaOH的浓度为2mol/L
C. 图②中物质A反应生成物质C,△H>0
D. 图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
难度: 中等查看答案及解析