-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①地热能 ②煤 ③天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A. ②⑤⑦⑧ B. ①④⑤⑦⑧ C. ④⑤⑦⑧ D. ②③⑥⑦⑧
难度: 简单查看答案及解析
-
下列说法正确的是
A. 任何条件下,化学反应的焓变都等于化学反应的反应热
B. 需要加热才能进行的反应一定是吸热反应
C. 物质具有的能量越高,物质的稳定性越强
D. 在确定的化学反应体系中,反应物的总能量与生成物的总能量一定不同
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是
A. 稀盐酸与氢氧化钠的反应 B. 甲烷在氧气中的燃烧反应
C. NH4Cl与Ba(OH)2·8H2O反应 D. 灼热的碳与CO2的反应
难度: 简单查看答案及解析
-
下列热化学方程式正确的是( )
A. C2H5OH+3O2=2CO2+3H2O △H=-1367.0kJ/mol
B. NaOH(aq)+ HCl( aq)=NaCl(aq)+ H2O(l) △H =+57.3 kJ/ mol
C. S(s)+ O2 (g)=SO2 (g) △H =-269.8 kJ/ mol
D. 2NO(g)+O2(g)=2NO2(g) △H =-116.2 kJ
难度: 中等查看答案及解析
-
下列说法正确的是
A. 化学反应速率是指一定时间内任何一种反应物浓度的减少或生成物浓度的增加
B. 根据化学反应速率的大小可以推知化学反应进行的快慢
C. 化学反应速率为0.8mol/(L·s)是指1s时某物质的浓度为0.8 mol/L
D. 对于化学反应来说,反应速率越大,反应现象就越明显
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
B. 盐酸与某强碱中和放出的热随反应物的用量改变而改变,但中和热不变
C. 燃烧热随化学方程式前面的化学计量数的改变而改变
D. 热化学方程式不仅能表示化学反应中的物质变化,也表明了其能量变化
难度: 简单查看答案及解析
-
下列说法正确的是
A. 可逆反应的特征是正反应速率和逆反应速率相等
B. 可逆反应达到化学平衡状态时,正逆反应就停止了
C. 在其他条件不变时,升高温度可以使平衡向吸热反应方向移动
D. 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
难度: 简单查看答案及解析
-
某同学按照实验要求,用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中正确的是
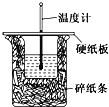
A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若烧杯上不盖硬纸板,测得的ΔH将偏小
难度: 简单查看答案及解析
-
已知HCl(g)=1/2H2(g)+1/2Cl2(g) △H=+92.3kJ·mol-1,则反应H2(g)+Cl2(g)=2HCl(g)的△H为
A. ―92.3kJ·mol-1 B. -184.6kJ·mol-1
C. ―369.2kJ·mol-1 D. +184.6kJ·mol-1
难度: 简单查看答案及解析
-
25℃、101 kPa下,4g氢气燃烧生成液态水,放出571.6 kJ热量,表示氢气燃烧热的热化学方程式正确的是
A. 4H2(g)+2O2(g)==4H2O(1) △H= ―571.6kJ/mol
B. 2H2(g)+ O2(g)==2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g)==2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2 O2(g)==H2O(1) △H = ―285.8kJ/mol
难度: 简单查看答案及解析
-
在一密闭容器中,发生反应3A(g)+B(g)
2Z(g),若最初A的物质的量浓度是2mol/L,测得10s内A的平均反应速率υ(A)=0.15mol/(L•s),则反应进行到10s时容器中A的物质的量浓度是
A. 3 mol/L B. 1.2 mol/L C. 0.5mol/L D. 3.5 mol/L
难度: 简单查看答案及解析
-
在密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B)=3 v (A), 3 v (C)=2 v (B)。 则此反应可表示为( )
A. 2A + 3B = 2C B. A+ 3B = 2C
C. 3A + B = 2C D. A + B = C
难度: 简单查看答案及解析
-
在四个不同的容器中,在不同的条件下进行合成氨3H2 +N2
2NH3反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A. v(NH3)=0.2 mol/(L•min) B. v(NH3)=0.4 mol/(L•min)
C. v(H2)=0.6 mol/(L•min) D. v(H2)=0.8 mol/(L•min)
难度: 简单查看答案及解析
-
2SO2(g) + O2(g)
2SO3(g)是制备硫酸的重要反应之一,其它条件不变时,改变下列影响化学反应速率的一个条件,可以加快反应速率的是
A. 使用催化剂 B. 减小反应体系的压强
C. 降低反应体系的温度 D. 将SO3从体系中分离出来
难度: 简单查看答案及解析
-
下列有关化学反应速率的说法正确的是
A. 升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间
B. 化学反应达到最大限度时,正逆反应速率也达到最大且相等
C. 增加固体反应物的量可以加快反应速率
D. 用铁片和稀硫酸反应制H2比用的浓硫酸产生H2的速率慢
难度: 简单查看答案及解析
-
已知热化学方程式:2SO2(g)+O2(g)
2SO3(g) △H=―196.64kJ/mol。在容器中充入1molSO2和0.5molO2充分反应,最终放出的热量为
A. 98.32kJ B. 98.32kJ/mol C. <98.32kJ D. >98.32kJ
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D. 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 中等查看答案及解析
-
下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+1/2O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+1/2O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(aq) △H2
A. ①④ B. ②③④ C. ② D. ①②③
难度: 简单查看答案及解析
-
下图是关于反应A2(g)+3B2(g)
2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )
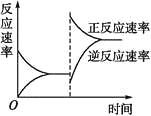
A. 升高温度,同时加压
B. 降低温度,同时减压
C. 增大反应物浓度,同时减小生成物浓度
D. 增大反应物浓度,同时使用催化剂
难度: 中等查看答案及解析
-
下列是4位同学在学习“化学反应速率和化学平衡”后,联系工业生产实际所发表的观点,你认为不正确的是
A. 化学反应速率理论是研究怎样提高原料转化率
B. 化学平衡理论是研究怎样使用有限原料多出产品
C. 化学反应速率理论是研究怎样在一定时间内快出产品
D. 化学平衡理论是研究怎样使原料尽可能多地转化为产品
难度: 简单查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
1/2N2(g)+CO2(g);ΔH= -373.2 kJ/mol,达到平衡后,为提高该反应的速率和 NO 的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入 N2 D. 降低温度同时增大压强
难度: 中等查看答案及解析
-
在密闭容器中进行反应N2+O2=2NO,下列条件能加快该反应速率的是
A. 增大容器体积 B. 体积不变,充入N2使压强增大
C. 体积不变,充入He使压强增大 D. 压强不变,充入He使体积增大
难度: 简单查看答案及解析


