-
下列有关物质的分类与性质的说法正确的是( )
A. 液氯、冰醋酸、C4H8均属于纯净物
B. SO3、SiO2均属于酸性氧化物
C. 已知:H3RO2+NaOH(足量)=NaH2RO2+H2O,则H3RO2为三元酸,NaH2RO2为酸式盐
D. 往任何胶体中加入任何电解质都能使胶体粒子聚沉
难度: 中等查看答案及解析
-
由下列实验得出的结论正确的是
选项
实验内容
结论
A
向某溶液中加入盐酸产生能使澄清石灰水变浑浊 的气体
该溶液中一定含有 CO32-或SO32-
B
向某溶液中加入少量的盐酸,生成白色沉淀
溶液中不一定含有 Ag+
C
将某有机物与 NaOH、乙醇混合共热后加入 AgNO3
溶液,没有出现白色沉淀
该有机物中不含氯原子
D
将液溴、苯、FeBr3 混合于烧瓶中反应,将产生的 气体导出至 AgNO3 溶液中,生成了淡黄色沉淀
液溴与苯的反应属于取代反应, 而不是加成反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学中常借助于图像这一表现手段以清晰地突出实验装置的要点,形象地阐述化学过程的原理。 下列有关化学图像表现的内容正确的是

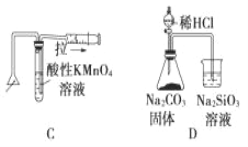
A. 测定一定时间内生成 H2 的反应速率 B. 提取海带中的碘
C. 检验火柴燃烧产生的 SO2 D. 证明非金属性:Cl>C>Si
难度: 中等查看答案及解析
-
某有机物的结构如图所示,有关该有机物的说法不正确的是
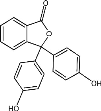
A. 该有机物的分子式为 C20H14O4
B. 该有机物分子中所有的原子不可能处于同一平面
C. 1mol 该有机物分别与 Br2、NaOH 反应, 最多能消耗 4molBr2、4molNaOH
D. 该有机物能发生加成、取代、氧化反应
难度: 中等查看答案及解析
-
下列描述的离子反应方程式正确的是
A. 少量的 SO2 通入 NaClO 溶液:SO2+H2O+2ClO-=SO32-+2HClO
B. 氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C. 用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓)
Mn2++2Cl―+Cl2↑+2H2O
D. 等浓度的 NaHSO4 与 Ba(OH)2 混合至溶液呈中性:Ba2++2OH―+SO42―+2H+=BaSO4↓+2H2O
难度: 困难查看答案及解析
-
向 100mL Na2CO3 与 NaAlO2 的混合溶液中逐滴加入 1mol/L 的盐酸,测得溶液中的 CO32-、HCO3- 、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是

A. 原 混 合 溶 液 中 的 n (CO32-): n (AlO2-)=2:1
B. a 点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C. b 点溶液中离子浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH- )
D. d→e 的过程中水的电离程度逐渐减小
难度: 困难查看答案及解析
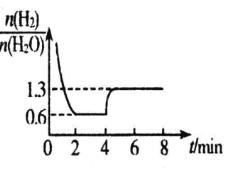
 中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。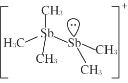 ,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。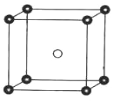



 的流程图(无机试剂任 选)。合成路线流程图示例如下:X
的流程图(无机试剂任 选)。合成路线流程图示例如下:X