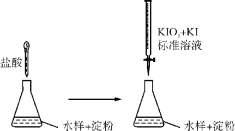
-
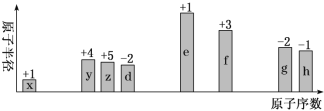
下列实验方案合理且能达到对应目的的是
实验目的
实验方案
A
制备Fe(OH)3胶体
向25 mL沸水中逐滴加入5~6滴饱和FeCl3溶液,加热煮沸至溶液呈红褐色
B
除去乙酸乙酯中的乙酸
向混合物中加入饱和氢氧化钠溶液,充分振落、静置、分液
C
比较HClO、HCN的酸性强弱
用pH试纸测浓度相同的NaClO溶液和NaCN溶液的pH值
D
测定中和反应的反应热
50 mL5.0 mol/L 的盐酸和 50 mL5.0 mol/L 的 NaOH 溶液反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
分类思想是研究化学的常用方法,下列分类叙述正确的是( )
A. 既有单质参加又有单质生成的反应一定是氧化还原反应
B. 淀粉、纤维素、油脂均属于天然高分子
C. 根据丁达尔现象可以将分散系分为溶液、胶体和浊液
D. 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
难度: 困难查看答案及解析
-
化学与人类生产、生活和社会可持续发展密切相关。下列说法不正确的是
A. “火树银花”中的焰火实质上是金属元素的焰色反应
B. 绿色化学的核心是应用化学原理对环境污染进行治理
C. 煤经过气化、液化和干馏等化学变化过程,可以转化为清洁能源
D. 氮氧化物受紫外线照射后与空气中的一些碳氢化合物作用后形成光化学烟雾
难度: 中等查看答案及解析
-
有一种军用烟幕弹中装有ZnO、Al粉和C2Cl6,其发烟过程中的化学反应如下:
①3ZnO+2Al→Al2O3+3Zn
②3Zn+C2Cl6→3ZnCl2+2C
下列有关叙述不正确的是
A. 反应①是铝热反应
B. 反应②是置换反应
C. C2Cl6属于卤代烃
D. 氧化性:Al>Zn>C
难度: 简单查看答案及解析
-
铜和Al的合金2.3g全溶于浓硝酸,若反应中硝酸被还原只产生2.24L的NO2气体和168mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入一定量的氢氧化钠溶液,使生成的沉淀的最大质量为
A. 4.1275g B. 4.255g C. 8.51g D. 9.62g
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 强酸性溶液中:Cu2+、K+、ClO-、SO42-
B. PH=6的溶液中:Fe3+、Al3+、SO42-、Cl-
C. 含有大量AlO2-的溶液中:K+、Na+、HCO3-、I-
D. 有色透明溶液中:Fe2+、Ba2+、Cl-、NO3-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为2NA
B. 标准状况下,22.4L一氯甲烷中含极性共价键数目为4NA
C. 标准状况下,22.4L HCl气体中含有NA个气体分子
D. 1mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 氢氧化亚铁在空气中的变化:2Fe(OH)2+O2+H2O=2Fe(OH)3
B. 硫酸亚铁溶液中加过氧化氢溶液:Fe2+ + 2H2O2 + 4H+=Fe3+ + 4H2O
C. 氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D. 硝酸铁溶液中加过量氨水:Fe3+ + 3NH3·H2O=Fe(OH)3 + 3NH4+
难度: 中等查看答案及解析
-
某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2,下列有关判断正确的是(提示:SOCl2中S显+4价)
A. 还原剂只有Li
B. SOCl2既是氧化剂又是还原剂
C. 还原产物包括LiCl和S
D. 生成1.12L SO2时,反应转移电子为0.2mol
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B. 铁粉作食品袋内的脱氧剂,铁粉起还原作用
C. FeCl3溶液可用于铜质印刷线路板制作,原因是FeCl3能从含有Cu2+的溶液中置换出铜
D. c(Fe2+)=1 mol·L-1的溶液中:K+、NH4+、MnO4-、S2-能大量共存
难度: 中等查看答案及解析
-
下列离子方程式的书写及评价均合理的是
选项
离子方程式
评价
A
将1molCl2通入到含1mol FeI2溶液中:2Fe2+
+2I-+2Cl2===2Fe3++4Cl-+I2
正确;Cl2过量,可将Fe2+、I-均氧化
B
1mol·L−1 NaAlO2溶液和2.5mol·L−1 HCl溶液等体积互相均匀混合: 2AlO2-+5H+===Al3+
+Al(OH)3↓+H2O
正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3
C
过量SO2通入到NaClO溶液中:SO2+H2O+
ClO-===HClO+HSO3-
正确;说明酸性:H2SO3强于HClO
D
Ca(HCO3)2与足量NaOH溶液反应: HCO3-+OH-=H2O+ CO32-
正确:说明酸式盐与碱反应生成正盐和水
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列依据实验操作及现象得出的结论正确的是
选项
实验操作
现象
结论
A
向亚硫酸钠试样中滴入盐酸酸化的
Ba(ClO) 2溶液
生成白色沉淀
试样己氧化变质
B
向Co2O3中滴入浓盐酸
产生黄绿色气体
氧化性:Co2O3>Cl2
C
向待测液中依次滴入氯水和KSCN溶液
溶液变为红色
待测溶液中含有Fe2+
D
向NaHCO3溶液中滴加NaAlO2溶液
有白色沉淀和气体产生
AlO2-与HCO3-发生了双水解反应
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
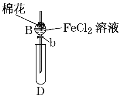
Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是
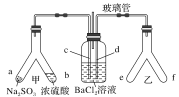
A. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
C. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
D. e、f两管中的试剂可以分别是浓氨水和NaOH固体
难度: 困难查看答案及解析
-
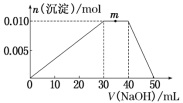
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol·L−1NaOH溶液,当滴加到V mL 时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是
A. 沉淀中氢氧根的质量为(n—m)克
B. 恰好溶解后溶液中的NO3-离子的物质的量为 bv/1000mol
C. 生成标准状况下NO气体的体积为 2.24(n-m)/17L
D. 与合金反应的硝酸的物质的量为bv/1000mol+(n-m)/51mol
难度: 困难查看答案及解析
-
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
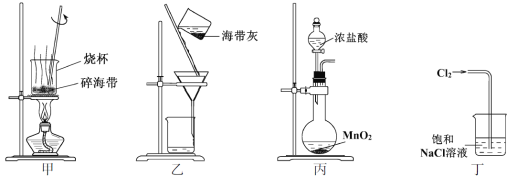
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是

A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
难度: 中等查看答案及解析