-
下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D. 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 中等查看答案及解析
-
在2A(g) +B(g)
3C(g) +4D(g) 反应中,表示该反应速率最快的是:( )
A. V(A)═0.5mol/(L·S) B. V(B)═0.3 mol/(L·S)
C. V(C)═0.8 mol/(L·S) D. V(D)═1 mol/(L·S)
难度: 简单查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是( )
A. 放热反应的反应速率总是大于吸热反应的反应速率
B. 已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,则中和热的热效应为57.3 kJ
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
难度: 中等查看答案及解析
-
在密闭容器中进行反应:2SO2(g)+O2(g)
2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻 突然变化的条件可能是( )
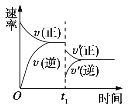
A. 催化剂失效 B. 减小生成物的浓度
C. 增大容器的体积 D. 降低体系温度
难度: 中等查看答案及解析
-
下列事实,能用勒夏特列原理解释的是( )
A. H2、I2、HI平衡混和气加压后颜色变深 B. 实验室中常用排饱和食盐水的方法收集Cl2
C. 合成氨控制在500 ℃左右的温度 D. SO2催化氧化成SO3的反应,往往需要使用催化剂
难度: 中等查看答案及解析
-
下列热化学方程式正确的是( )
A. 甲烷的燃烧热为890.3kJ·mol−1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=−890.3 kJ·mol−1
B. 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=−38.6kJ·mol−1
C. 已知在120℃、101kPa下,1g H2燃烧生成水蒸气放出121kJ热量,其热化学方程式为H2(g)+1/2O2(g)=H2O(g) ΔH=−242kJ·mol−1
D. 25℃、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol−1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=−57.3kJ·mol−1
难度: 困难查看答案及解析
-
在密闭容器中进行反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是
A. Z为0.3 mol·L-1 B. Y2为0.4 mol·L-1
C. X2为0.2 mol·L-1 D. Z为0.4 mol·L-1
难度: 中等查看答案及解析
-
已知在300 K时,发生反应:A(g)+B(g)
2C(g)+D(s),在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时生成a mol D ③A、B、C的物质的量浓度之比为1∶1∶2 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化
A. ③⑤ B. ②④⑤ C. ②③⑤ D. ③⑤⑥
难度: 中等查看答案及解析
-
中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是( )
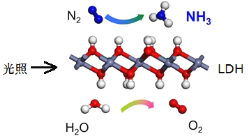
A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及非极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
难度: 困难查看答案及解析
-
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图,已知断裂1 mol N≡N键吸收942kJ热量,生成1 mol N-N键释放167 kJ热量根据以上信息和数据,下列热化学方程式正确的是( )
A. 2N2=N4 △H =-882 kJ·mol-1
B. N2 (g)=0.5N4 (g) △H=+441 kJ
C. N2 (g)=0.5N4 (g) △H=-441 kJ·mol-1
D. 2N2(g)=N4(g) △H=+882 kJ·mol-1
难度: 困难查看答案及解析
-
已知反应:
PCl5(g
)PCl3(g)+Cl2(g) ①
2HI(g)
H2(g)+I2(g) ②
2NO2(g)
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%,若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率
A. 均不变 B. 均增大
C. ①增大,②不变,③减小 D. ①减小,②不变,③增大
难度: 中等查看答案及解析
-
已知1 g H2完全燃烧生成水蒸气时放出热量121 kJ,且O2中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收热量为( )
A. 920 kJ B. 557 kJ C. 188kJ D. 436 kJ
难度: 中等查看答案及解析
-
已建立化学平衡的某可逆反应X(g)+2Y(g)
2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
①生成物的质量分数一定增加,②生成物总量一定增加, ③反应物的转化率一定增大,
④反应物的浓度一定降低,⑤正反应速率一定大于逆反应速率,⑥一定使用催化剂
A.①②③ B.③④⑤ C.②⑤ D.④⑥
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A. ①④ B. ②③ C. ①③ D. ②④
难度: 困难查看答案及解析
-
如图是温度和压强对反应X+Y
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
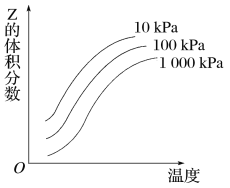
A. 上述可逆反应的正反应为放热反应
B. X、Y、Z均为气态
C. X和Y中最多只有一种为气态,Z为气态
D. 上述反应的逆反应的ΔH>0
难度: 中等查看答案及解析
-
在密闭容器中充入一定量NO2,发生反应2NO2(g)
N2O4(g) ΔH=-57 kJ· mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
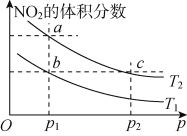
A. a、c两点的反应速率:a>c
B. a、b两点NO2的转化率:a<b
C. a、c两点气体的颜色:a深,c浅
D. 由a点到b点,可以用加热的方法
难度: 中等查看答案及解析
-
已知下列热化学方程式,有关反应焓变的判断正确的是( )
C(s)+O2(g)=CO2(g) ΔH1 CO2(g)+C(s)=2CO(g) ΔH2 2CO(g)+O2(g)=2CO2(g) ΔH3
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5
A. ΔH1>0,ΔH3<0 B. ΔH2>0,ΔH4>0
C. ΔH1=ΔH2+ΔH3 D. ΔH3=ΔH4+ΔH5
难度: 简单查看答案及解析
-
在2升的密闭容器中,发生以下反应:2A(气)+B(气)
2C气+D(气)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
难度: 中等查看答案及解析
-
完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,需消耗50 mL 8 mol/L的氢氧化钠溶液,则燃烧1mol无水乙醇放出的热量不可能是( )
A. 10Q B. 5Q~10Q C. 大于10Q D. 5Q
难度: 中等查看答案及解析
-
已知正丁烷(CH3CH2CH2CH3)和异丁烷[(CH3)2CHCH3]燃烧的热化学方程式分别如下:
CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) ΔH=-2878 kJ·mol-1
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) ΔH=-2869 kJ·mol-1
下列说法正确的是( )
A. 正丁烷分子储存的能量大于异丁烷分子 B. 正丁烷的稳定性大于异丁烷
C. 异丁烷转化为正丁烷的过程是一个放热过程 D. 异丁烷分子中的碳氢键比正丁烷的多
难度: 中等查看答案及解析
-
在密闭容中发生下列反应aA(g)
cC(g)+dD(g),压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a<c+d
难度: 中等查看答案及解析
-
已知某可逆反应mA(g)+nB(g)
pC(g)在密闭容器中进行,如图表示在不同反应时间(t)时,温度(T)和压强(p)与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是
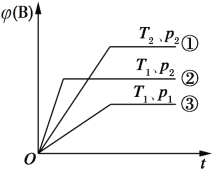
A. T1<T2,p1>p2,m+n>p,放热反应 B. T1>T2,p1<p2,m+n>p,吸热反应
C. T1<T2,p1>p2,m+n<p,放热反应 D. T1>T2,p1<p2,m+n<p,吸热反应
难度: 困难查看答案及解析
-
已知下列热化学方程式:
①Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) ΔH1=-26.7 kJ·mol-1
②3Fe2O3(s)+CO(g)= 2Fe3O4(s)+CO2(g) ΔH2=-50.75 kJ·mol-1
③Fe3O4(s)+CO(g)= 3FeO(s)+CO2(g) ΔH3=-36.5 kJ·mol-1
则试通过计算判断,下列有关反应FeO(s)+CO(g)=Fe(s)+CO2(g)的能量变化示意图正确的是
A.
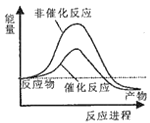 B.
B. 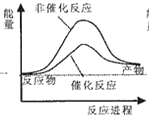 C.
C. 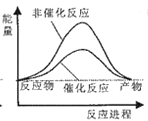 D.
D. 
难度: 困难查看答案及解析
-
已知:2SO2(g)+O2(g)
2SO3(g);ΔH=-196.6 kJ/mol。实验室测得4 mol SO2发生上述化学反应时放出314.3 kJ热量,SO2的转化率最接近于
A. 40% B. 50% C. 80% D. 90%
难度: 中等查看答案及解析
-
物质的生成热可定义为:由稳定单质生成1 mol物质所放出的热量。如CO2气体的生成热就是反应C(s)+O2(g)=CO2(g)的反应热。已知下表中几种化合物的生成热。则1 mol葡萄糖在人体内完全氧化成CO2和液态水最多可提供的能量为( )
化合物
葡萄糖
H2O(l)
CO2(g)
生成热(kJ/mol)
1259.8
285.8
393.5
A. 3225 kJ B. 2816 kJ C. 6999 kJ D. 15644 kJ
难度: 中等查看答案及解析