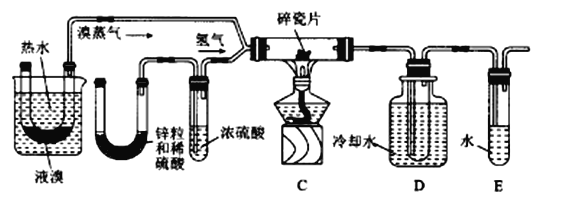
-
(2014•长宁区一模)①②③④甲种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
难度: 中等查看答案及解析
-
醋酸铅[(CH3COO)2Pb]因有甜味而被称为“铅糖”,它有毒但能入药。已知(CH3COO)2Pb可溶于水,硝酸铅与醋酸钠溶液反应的离子方程式为Pb2++2CH3COO-
(CH3COO)2Pb。下列有关说法中不正确的是
A. 0.1 mol·L-1的“铅糖”溶液中c(Pb2+)<0.1 mol·L-1
B. “铅糖”是强电解质
C. “铅糖”是共价化合物
D. “铅糖”的溶液可能导电性很弱
难度: 中等查看答案及解析
-
某反应由两步反应A→B→C构成,它的反应过程中能量变化曲线如右图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是

A. 两步反应均为吸热反应 B. 加入催化剂会改变反应的焓变
C. 三种物质中C最稳定 D. A→C反应中ΔH=E1-E2
难度: 简单查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH=" x" kJ·mol-1
已知硫的燃烧热ΔH1=" a" kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2=" b" kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3=" c" kJ·mol-1
则x为
A. 3a+b-c B. c +3a-b C. a+b-c D. c+a-b
难度: 中等查看答案及解析
-
下列反应中,一定不能自发进行的是
A. 2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03 kJ/mol ΔS=1 110 J/(mol·K)
B. CO(g)===C(石墨,s)+1/2O2(g) ΔH=+110.5 kJ/mol ΔS=-89.36 J/(mol·K)
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3 kJ/mol ΔS=-280.1 J/(mol·K)
D. NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=+37.301 kJ/mol ΔS=184.05 J/(mol·K)
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使酚酞变红色的溶液中: Na+、Al3+、SO42-、Cl-
B. 与Al反应能放出H2的溶液中: Fe2+、K+、NO3- 、SO42-
C. Kw/c(H+)=1×10-13 mol·L-1的溶液中: NH4+、Ca2+、Cl-、NO3-
D. 水电离的c(H+)=1×10-13 mol·L-1的溶液中: K+、Na+、AlO2- 、CO32-
难度: 中等查看答案及解析
-
常温下,关于溶液的稀释下列说法正确的是
A. pH=3的醋酸溶液稀释100倍,pH=5
B. 将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13
C. pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1.0×10-6 mol·L-1
D. pH=8的NaOH溶液稀释100倍,其pH=6
难度: 中等查看答案及解析
-
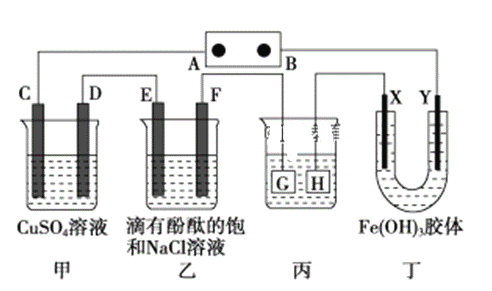
某学习小组的同学查阅相关资料知,氧化性:Cr2O72->Fe3+,设计了如图所示的盐桥原电池。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是
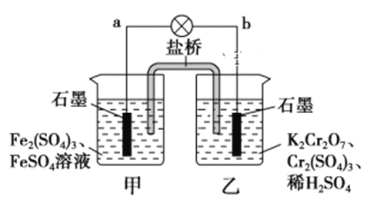
A. 甲烧杯的溶液中发生还原反应
B. 外电路的电流方向是从b到a
C. 电池工作时,盐桥中的SO42-移向乙烧杯
D. 乙烧杯中发生的电极反应为:2Cr3++7H2O-6e-===Cr2O72-+14H+
难度: 中等查看答案及解析
-
五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
X
Y
Z
M
R
A. 元素的非金属性大小:Y>X>R B. 简单气态氢化物稳定性:M>R
C. Z的氧化物可以作光导纤维 D. 最高价氧化物对应水化物酸性:Y>X
难度: 中等查看答案及解析
-
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是
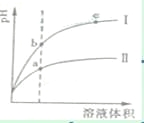
A. Ⅱ为盐酸稀释时pH值变化曲线 B. b点溶液的导电性比c点溶液的导电性强 C. a点Ka的数值比c点Ku的数值大 D. b点酸的总浓度大于a点酸的总浓度
难度: 中等查看答案及解析
-
(题文)将V1 mL 1.00 mol·L-1HCl溶液V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
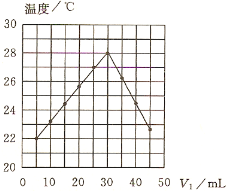
A. 做该实验时环境温度为22 ℃
B. 该实验表明化学能可以转化为热能
C. NaOH溶液的浓度约是1.00 mol·L-1
D. 该实验表明有水生成的反应都是放热反应
难度: 简单查看答案及解析
-
A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g)
cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表。下列说法正确的是
n(B)/mol
n(C)/mol
n(D)/mol
反应时间/min
0.12
0.06
0.10
t1
0.06
0.12
0.20
t2
A. 0~t1时间段内,平均反应速率v(B)=0.04/t1 mol·(L·min)-1
B. 若起始时n(D)=0,则t2时刻v(D)=0.20/t2 mol·(L·min)-1
C. 升高温度,v(B)、v(C)、v(D)均增大
D. b∶d=6∶1
难度: 中等查看答案及解析
-
t ℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g)
cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
A. 重新达到平衡时,D的体积分数减小 B. a+b<c+d
C. 重新达到平衡时,A气体的浓度增大 D. 平衡向右移动
难度: 中等查看答案及解析
-
如图,甲容器有一个移动活塞,能使容器保持恒压。起始时,关闭活塞K,向甲中充入2mol SO2、1mol O2,向乙中充入4 mol SO2、2 mol O2。甲、乙的体积都为1 L(连通管体积忽略不计)。保持相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:2SO2(g)+O2(g)
2SO3(g)。达平衡时,甲的体积为0.8 L。下列说法正确的是
A. 乙容器中SO2的转化率小于60%
B. 平衡时SO3的体积分数:甲>乙
C. 打开K后一段时间,再次达到平衡,甲的体积为1.4 L
D. 平衡后向甲中再充入2 mol SO2、1 mol O2和3 mol SO3,平衡向正反应方向移动
难度: 中等查看答案及解析