-
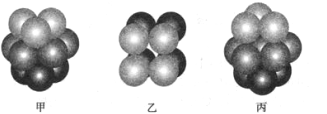
下列实验操作对应的实验现象及解释或结论不正确的是
选项
实验操作
实验现象
解释或结论
A
将相同大小的金属钠分别投入乙醇和水中
乙醇与钠反应缓慢,水与钠反应剧烈
乙醇羟基中的氢原子不如水分子中的氢原子活泼
B
向 2 mL 1 mol/L NaOH 溶液中先加入3滴 1 mol/L MgCl2,再加入3滴 1 mol/L
FeCl3 溶液
先生成白色沉淀,后生成红褐色沉淀
证明 Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
C
将水蒸气通过灼热的铁粉
生成的气体可以点燃
铁与水蒸气在高溫下发生反应
D
将刚摘下的红色花朵放入盛满干燥氯气的集气瓶中,盖上玻璃片
花朵褪色
因为次氯酸具有漂白作用
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A. 泡沫灭火器可用于一般的起火,也适用于电器起火
B. 疫苗一般应冷藏存放,以避免蛋白质变性
C. 家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D. 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O===SO42-+2Fe 2++4H+;
②Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
下列有关说法不正确的是
A. SO2发生氧化反应
B. 氧化性:SO42- < Fe3+ < Cr2O72-
C. 每0.2 mol K2Cr2O7参加反应,转移电子的数目为1.2NA
D. 若有13.44 L SO2(标准状况)参加反应,则最终消耗0.4mol K2Cr2O7
难度: 中等查看答案及解析
-
W、X、Y是原子序数依次增大的同一短周期元素。W、X是金属元素,它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,W与Y可形成化合物W2Y。下列说法正确的是
A. Y的低价氧化物与O3漂白的原理相同
B. Y的氢化物和W2Y所含化学键的类型相同
C. 上述三种元素形成的简单离子,X离子半径最小
D. 工业上常用电解相应的盐溶液制备W、X的单质
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,124gP4中所含P—P键数目为4NA
B. 100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A. H3O+的电子式:
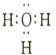 B. 间硝基甲苯的结构简式:
B. 间硝基甲苯的结构简式:
C. 中子数为 10 的氧原子:
D. NaHS 显碱性的原因:HS-+H2O=S2-+H3O+
难度: 中等查看答案及解析
-
X常温下为气体, a、b、c 是中学化学常见物质, 均由常见元素组成, 转化关系(反应条件略去)如图所示, 下列说法不正确的是
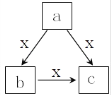
A. 若 b 为固态非金属单质,b 与 X 所含元素同主族,则c也能与 X 反应
B. 若 X 为 O2,a 为一种固态单质,则c可能为CO2或 SO3
C. 若 a、b、c 焰色反应均呈黄色,水溶液均呈碱性,则a中可能既含有离子键又含有共价键
D. 若 b 为气态非金属单质,b 与 X 所含元素同周期,则 X 与 b 所含元素原子的核电荷数相差1
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2 溶液:Mg2++2Cl-+2H2O
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3
Al2(CO3)3↓
C. 向Ca(HCO3)2 溶液中滴加少量NaOH溶液:Ca2++2
+2OH-
CaCO3↓+
+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI 溶液:2
+8H++6I-
3I2+2NO↑+4H2O
难度: 困难查看答案及解析
-
以反应 5H2C2O4+2MnO4 -+6H+ = 10CO2↑+ 2Mn2+ + 8H2O 为例探究“外界条件对化学反应速率的影响”。实验时,分别量取 H2C2O4 溶液和酸性 KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
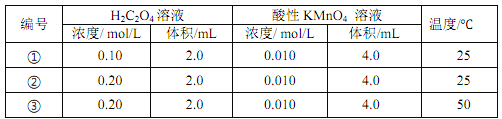
下列说法不正确的是
A. 实验①、 ②、 ③所加的H2C2O4 溶液均要过量
B. 若实验①测得 KMnO4溶液的褪色时间为 40 s, 则这段时间内平均反应速率 v(KMnO4)= 2. 5×10-4 mol/L/s
C. 实验①和实验②是探究浓度对化学反应速率的影响, 实验②和③是探究温度对化学反应速率的影响
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的 Mn2+对反应起催化作用
难度: 中等查看答案及解析
-
已知草酸晶体(H2C2O4·2H2O)的熔点为101℃,170℃分解。下列选用的装置和药品能达到实验目的的是
A
B
C
D
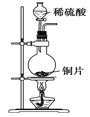
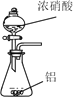
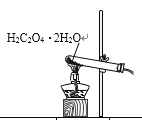
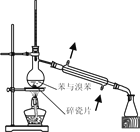
制取SO2
制取NO2
H2C2O4·2H2O分解
分离苯与溴苯
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是
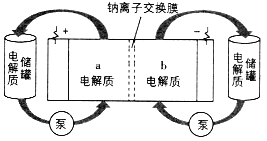
A. 放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e- =Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40 gNa2S4
难度: 困难查看答案及解析
-
根据下列各图曲线表征的信息,得出的结论不正确的是
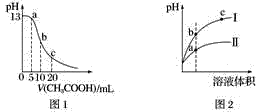
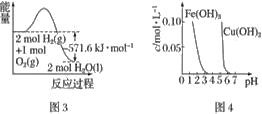
A. 图1表示常温下向体积为10 mL 0.1 mol·L−1NaOH溶液中逐滴加入0.1 mol·L−1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH−)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol−1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
难度: 困难查看答案及解析
-
常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示(已知:p
= –lg
)。下列叙述不正确的是
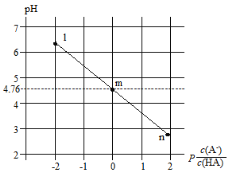
A. Ka(HA)为10-4.76
B. 滴加NaOH溶液过程中,
不变
C. m点所示溶液中:c(H+)=c(HA)+c(OH-)−c(Na+)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
难度: 困难查看答案及解析