-
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是
A. 铜铸塑像上出现铜绿Cu2(OH)2CO3 B. 铁制菜刀生锈
C. 大理石雕像被酸雨腐蚀毁坏 D. 铝锅表面生成致密的薄膜(氧化铝)
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. HNO3是挥发性一元强酸
B. Al2O3既是金属氧化物,也是碱性氧化物
C. 氧气和臭氧的相互转化是物理变化
D. 利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来
难度: 简单查看答案及解析
-
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原理是
A. 胶体的电泳 B. 血液的氧化还原反应
C. 血液中发生复分解反应 D. 胶体的聚沉
难度: 中等查看答案及解析
-
下列有关电解质与非电解质的叙述,正确的是( )
A. 液态HCl、固体氯化钠均不导电,所以二者均为非电解质
B. NH3、CO2的水溶液均能导电,所以二者均为电解质
C. 蔗糖在水溶液里或熔融状态时均不导电,所以它是非电解质
D. 铜、石墨均能导电,所以它们是电解质
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
①碳酸钙跟醋酸反应:CaCO3+2H+===Ca2++CO2 ↑+H 2O
②铁跟稀盐酸反应:Fe+2H+===Fe2++H2 ↑
③碘化钾溶液跟适量溴水反应:I-+Br2 ===2Br-+I2
④铁跟硫酸铜反应:Cu2++Fe===Fe2++Cu2+
⑤碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++HCO3- +OH-===CaCO3↓+H2O
A. ①② B. ②⑤ C. ③④ D. ②④
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1 mol·L-1KNO3溶液:Mg2+、Fe3+、Cl-、SO42-
B. 无色透明的溶液:Cu2+、NH4+、NO3-、CO32-
C. 使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO-
D. 水电离出的c(H+)=10-2 mol·L-1的溶液:Na+、NH4+、SO42-、NO3-
难度: 简单查看答案及解析
-
在反应2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O中)
A. 氧化产物与还原产物粒子个数比是2∶5
B. 被氧化的HCl占参加反应HCl总分子数的5/8
C. KMnO4只有一部分发生还原反应
D. KMnO4与HCl恰好分别完全发生还原反应和氧化反应
难度: 中等查看答案及解析
-
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+; Cl2→Cl-; HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. Fe3+ B. MnO4- C. Cl2 D. HNO2
难度: 中等查看答案及解析
-
为了使宇航员在飞船中得到一个稳定的,良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 ( )
A. Na2O2中阴、阳离子的个数比为1∶1
B. Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C. Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D. Na2O2的漂白原理与SO2的漂白原理相同
难度: 简单查看答案及解析
-
下面有关Na2CO3 与NaHCO3的叙述错误的是 ( )
A. Na2CO3遇少量酸可转化为NaHCO3
B. 在水中的溶解度Na2CO3比NaHCO3大
C. 与同浓度的硫酸反应时,Na2CO3比NaHCO3剧烈
D. NaHCO3能与NaOH反应,而Na2CO3不能
难度: 简单查看答案及解析
-
金属及其化合物转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不全部是通过一步反应完成的是( )。
A. Na→NaOH→Na2CO3→NaCl B. Fe→Fe(NO3)3→Fe(OH)3→Fe2O3
C. Mg→MgCl2→Mg(OH)2→MgSO4 D. Al→Al2O3→Al(OH)3→AlCl3
难度: 中等查看答案及解析
-
下列实验过程中产生的现象与对应的图象不相符的是( )
A. 向氢氧化钠溶液中滴加氯化铝
 B. 向偏铝酸钠溶液中滴加盐酸至过量
B. 向偏铝酸钠溶液中滴加盐酸至过量 C. 向碳酸钠溶液中逐滴加入盐酸
C. 向碳酸钠溶液中逐滴加入盐酸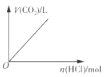 D. 向含有铝离子和镁离子的溶液中加入氢氧化钠至过量
D. 向含有铝离子和镁离子的溶液中加入氢氧化钠至过量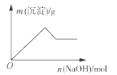
难度: 困难查看答案及解析
-
将Fe、Cu、FeCl2、FeCl3、CuCl2盛于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是 ( )
A. Cu、Fe3+ B. Fe2+、Fe3+ C. Cu、Cu2+、Fe D. Cu、Fe2+、Fe
难度: 中等查看答案及解析
-
下列各组溶液,只要用试管和胶头滴管,不用任何试剂就可鉴别的是( )
A. KOH和Al2(SO4)3; B. H2SO4和Na2CO3;
C. CaCl2和Na2CO3; D. Ba(OH)2和NaHSO4。
难度: 中等查看答案及解析
-
下列有关金属的工业制法中,正确的是
A. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B. 制铁:以铁矿石为原料,CO还原得铁
C. 制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁
D. 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝
难度: 中等查看答案及解析
-
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项
陈述Ⅰ
陈述Ⅱ
判断
A
碳酸钠溶液可用于治疗胃病
Na2CO3可与盐酸反应
Ⅰ对,Ⅱ对,有
B
向Na2O2的水溶液中滴入酚酞变红色
Na2O2与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠保存在煤油中,以隔绝空气
常温下,金属钠在空气中会生成过氧化钠
Ⅰ对,Ⅱ对,有
D
过氧化钠可用于航天员的供氧剂
Na2O2能和CO2、H2O反应生成O2
Ⅰ对,Ⅱ对,有
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
把a g 铝铁合金粉末溶于足量盐酸中,再加入过量氢氧化钠溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则此合金中铝的质量分数为( )
A. 70% B. 30% C. 52.4% D. 22.2%
难度: 简单查看答案及解析