-
下列物质性质与应用对应关系正确的是
A. 氨气具有还原性,可用于检查HCl泄漏
B. 浓硫酸具有脱水性,可用于干燥CO2
C. 明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂
D. 四氯化碳密度比水大,可用于萃取溴水中的Br2
难度: 中等查看答案及解析
-
下列气体的制备和性质实验中,由现象得出的结论错误的是
选项
试剂
试纸或试液
现象
结论
A
浓氨水、生石灰
湿红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
湿pH试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17 %。下列说法不正确的是
A. CO2属于酸性氧化物 B. 使用氢能源替代化石燃料可减少CO2排放
C. 可用Na2CO3溶液捕捉(吸收)CO2 D. CO2是导致酸雨发生的主要原因
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 质子数为92、中子数为143的铀(U)原子:
U
B. 过氧化氢的电子式:
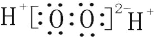
C. 氯离子的结构示意图:
D. H2CO3的电离方程式:H2CO3
2H++CO32-
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. pH=1的无色溶液中:Na+、Cu2+、Cl-、CO32-
B. 使酚酞呈红色的溶液中:K+、Na+、NO3-、Cl-
C. 0.1 mol/L的FeCl2溶液中:H+、Al3+、SO42-、ClO-
D. 由水电离出的c(H+)=1×10-10mol/L的溶液中:Mg2+、NH4+、SO42-、HCO3-
难度: 困难查看答案及解析
-
化学在生产和日常生活中有着重要的作用,下列叙述正确的是
A. 氧化铝的熔点很低,不能用于制作耐高温材料
B. 光化学烟雾与氮氧化合物有关
C. 无水乙醇用作医用消毒剂效果更好
D. Na、S、C分别在氧气中燃烧均可得到两种不同的氧化物
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. SO2使氯水褪色:SO2+Cl2+2H2O=4H++SO42-+2Cl-
B. Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
C. Ca(ClO)2溶液中通入过量CO2:2ClO- + CO2 + H2O =2HClO + CO32-
D. Fe(NO3)2溶液中加入过量的HI溶液:2Fe3++2I—=2Fe2++I2
难度: 中等查看答案及解析
-
下列各组物质中,不能满足组内任意两种物质在一定条件下均能发生反应的是
组别
物质
甲
乙
丙
A
H2SO4
NH4HCO3
Ba(OH)2
B
H2S
NaOH
SO2
C
NH3
NO2
HNO3
D
Na
H2O
Cl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,不能达到实验目的的是( )
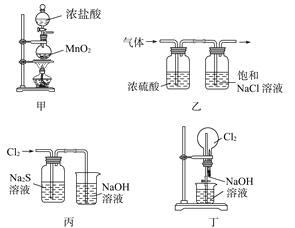
A. 用装置甲制取氯气
B. 用装置乙除去氯气中的少量氯化氢和水蒸气
C. 用装置丙可证明Cl2的氧化性强于S
D. 用装置丁可以完成“喷泉”实验
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2 L CCl4中含有的分子数为0.5 NA
B. 1 mol Cl2完全溶于水,转移的电子数为NA
C. 0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA
D. 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
A. S
SO3
H2SO4 B. NH3
N2
HNO3
C. SiO2
Si
SiCl4
Si D. 海水
Mg(OH)2
Mg
难度: 中等查看答案及解析
-
阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,不正确的是
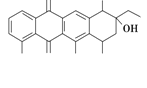
A. 阿克拉酮的分子式为C22H22O8
B. 分子中含有3个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质最多可与3 mol NaOH反应
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 mol·L-1 KSCN溶液中:Fe3+、NH4+、Br-、SO42-
B. c(OH-)/c(H+) =106的溶液中:NH4+ 、K+、AlO2-、NO3-
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl-
D. 0.1 mol·L-1 Ca(NO3)2溶液中:Na+、NH4+、CO32-、CH3COO-
难度: 困难查看答案及解析
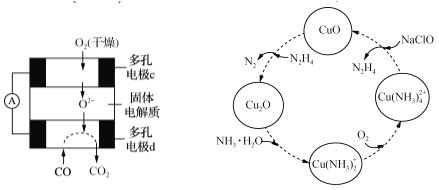
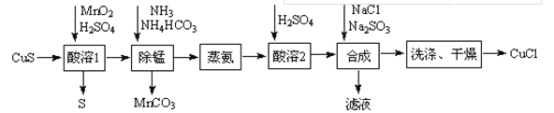
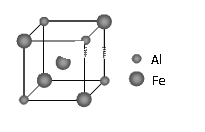
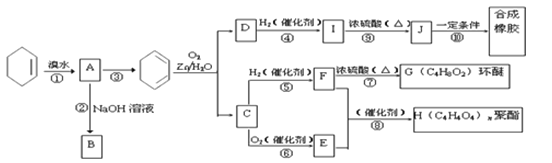
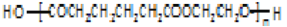 是一种广泛应用的高分子材料,请用环己烯和乙烯合成该有机物,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_____
是一种广泛应用的高分子材料,请用环己烯和乙烯合成该有机物,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_____