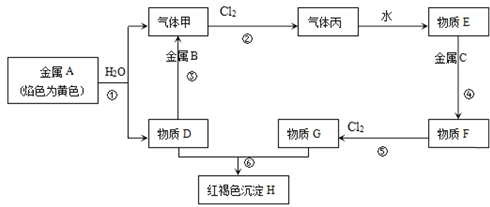
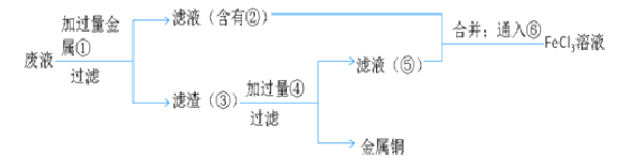
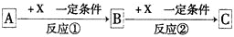-
下列各组中的两种物质作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )
A. Na和O2 B. NaOH和CO2
C. Na2O2和CO2 D. NaHCO3和Ca(OH)2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. “雨后彩虹”是与胶体、光学等知识有关的自然现象
B. “百炼成钢”主要发生了物理变化
C. “返青粽叶”指的是添加胆矾(CuSO4•5H2O)后的粽叶青绿新鲜,长期食用有害健康,其中胆矾是混合物
D. “明矾净水”与漂白粉用于自来水消毒的原理相同
难度: 中等查看答案及解析
-
已知:2Fe3++2I−===2Fe2++I2,Br2+2Fe2+===2Br−+2Fe3+,由此可判断离子的还原性从强到弱的顺序是
A. Br−>Fe2+>I− B. I−>Fe2+>Br− C. Br−>I−>Fe2+ D. Fe2+>I−>Br−
难度: 中等查看答案及解析
-
氧化还原反应在生产、生活中具有广泛的用途。下列做法中涉及到铝元素的还原性的是( )
A. 明矾净化水
B. 用氢氧化铝治疗胃酸过多
C. 用铝制容器存放浓硫酸
D. 电解熔融氧化铝制单质铝
难度: 简单查看答案及解析
-
Na2O2是一种既有氧化性、又有还原性的物质,当Na2O2与CO2发生反应并且有氧气生成时,下列有关说法正确的是( )
A. CO2一定是氧化剂
B. 当有1 mol O2生成时转移电子4 mol
C. O2一定是氧化产物
D. Na2O2不可能发生还原反应
难度: 中等查看答案及解析
-
焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A. 非金属单质燃烧时火焰均为无色
B. 所有金属及其化合物灼烧时火焰均有颜色
C. 焰色反应均应透过蓝色钴玻璃观察
D. NaCl与Na2CO3灼烧时火焰颜色相同
难度: 简单查看答案及解析
-
下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
难度: 中等查看答案及解析
-
要证明某溶液中不含有Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A. ①③ B. ②③
C. ③① D. ①②③
难度: 中等查看答案及解析
-
某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子,若向其中加入Na2O2粉末,则充分反应后溶液中离子浓度保持不变的是(溶液体积变化忽略不计)
A. CO32- NO3- Na+ B. CO32- NO3- C. SO32- NO3- D. NO3-
难度: 中等查看答案及解析
-
下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象不相同的是( )
A. AlCl3 和NH3 .H2O B. NaAlO2和HCl
C. NaHCO3和HCl D. NaCl和AgNO3
难度: 中等查看答案及解析
-
下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )
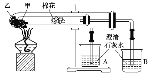
A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
难度: 困难查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是:
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
B. 浓烧碱溶液中加入铝片:Al+2OH-=AlO2—+H2↑
C. 用浓NaOH溶液溶解Al2O3:2OH-+Al2O3=2AlO2—+H2O
D. 往碳酸镁中滴加稀盐酸:CO32—+2H+=CO2↑+H2O
难度: 简单查看答案及解析
-
下列各组物质,不能按
(“―→”表示反应一步完成)关系转化的是( )
选项
a
b
c
A
Al2O3
NaAlO2
Al(OH)3
B
AlCl3
Al(OH)3
NaAlO2
C
Al
Al(OH)3
Al2O3
D
MgCl2
Mg(OH)2
MgO
A. A B. B C. C D. D
难度: 简单查看答案及解析