-
政府工作报告里的“环保强音”,见证美丽中国建设铿锵步伐。下列提议不可行的是( )
A. 禁止使用化肥农药,以防止水体污染
B. 使用清洁能源,以节约化石燃料
C. 严禁随意焚烧秸秆,以减少PM2.5的排放
D. 分类回收垃圾,以促进资源再生
难度: 简单查看答案及解析
-
“要敬畏化学,不学好化学,就别折腾化学”,响水县天嘉宜化工公司经营范围包括间羟基苯甲酸、苯甲醚等,就在本月21日下午2点48分,突然发生爆炸,遇难人数已升至48人,重伤90人,如图是微信热传的“苯宝宝表情包”,苯(化学式C6H6)、六氯苯(化学式C6Cl6)都是重要的化工原料,下列有关说法正确的是( )

A. 苯分子由碳、氢两种元素组成
B. 苯中氢元素的质量分数小于10%
C. 六氯苯中碳氯两种元素的质量比为1:1
D. 六氯苯由6个碳原子和6个氯原子构成
难度: 简单查看答案及解析
-
“丹砂烧之成水银”中的“丹砂”指的是硫化汞。该反应的微观示意图如下,有关说法正确的是( )

A. “●”代表非金属单质汞 B. 此反应遵循质量守恒定律
C. 反应前后原子的种类发生改变 D. 反应前后各元素的化合价都不变
难度: 简单查看答案及解析
-
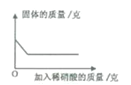
20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )
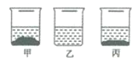
A. 所得溶液可能都是饱和溶液
B. 20℃时,乙溶液的溶质质量最小
C. 溶液溶质的质量分数:甲>丙>乙
D. 升高温度,溶液溶质的质量分数一定变大
难度: 中等查看答案及解析
-
下列实验操作能达到预期目的是( )
①用20mL水和20mL酒精配制成40mL酒精溶液;
②用量筒量取5.62mL的水;
③用托盘天平称量5.6gNaCl固体;
④用托盘天平、烧杯、量筒、玻璃捧配制一定温度下30%的NaCl的溶液.
A. ③ B. ③④ C. ②③ D. ①④
难度: 简单查看答案及解析