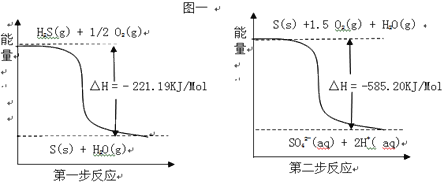
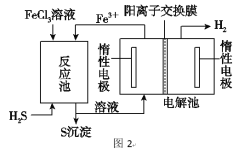
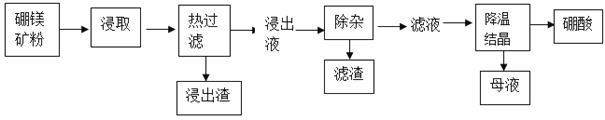
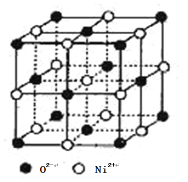
-
下列关于化学与生活的认识正确的是
A. 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
B. 新鲜蔬菜做熟后,所含维生素C不会有损失
C. 常温下铝遇浓硝酸钝化,可用铝罐车运输浓硝酸
D. “天宫一号”使用的碳纤维,是一种新型有机高分子材料
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
B. 常温常压下,14gC2H4和C4H8混合气体含有的碳原子数为NA
C. 标准状况下,4.48 L HF所含的分子数目为0.2NA
D. 在氢氧化铁胶体的制备中如果有1 mol 三氯化铁水解,则氢氧化铁胶粒数为NA
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论合理的是
选项
实验操作
实验现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液变成浅绿色
稀硝酸将Fe直接氧化为Fe2+
B
向浓度均为0.1 mol·L-1NaCl和NaI的混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
将硫酸酸化的H2O2滴入Fe(NO3)2溶液
溶液变黄色
H2O2的氧化性比
Fe3+强
D
向淀粉溶液中加入稀H2SO4,加热一段时间,冷却后加入新制Cu(OH)2,煮沸
没有生成砖红色沉淀
淀粉未水解
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A. 碘水中通入适量的SO2:I2+SO2+2H2O===2I-+SO42-+4H+
B. NH4HCO3溶液与足量NaOH溶液混合后加热:NH4++OH-
NH3↑+H2O
C. 向草酸(H2C2O4)溶液中滴加少量的氢氧化钠溶液:H2C2O4+2OH-===2H2O+ C2O42-
D. 向Ca(ClO) 2溶液中通入SO2:Ca2++2ClO-+H2O+SO2===CaSO3↓+2HClO
难度: 中等查看答案及解析
-
柠檬烯具有良好的镇咳、祛痰、抑菌作用,其结构如图所示。下列关于柠檬烯的说法正确的是
A. 分子式为C10H14
B. 分子中所有碳原子可能都处于同一平面上
C. 属于乙烯的同系物
D. 能发生取代反应和加成反应
难度: 简单查看答案及解析
-
苯环上有两个侧链的有机物C10H14 ,其同分异构体的数目为
A. 3种 B. 5种 C. 6种 D. 9种
难度: 困难查看答案及解析