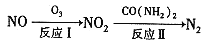-
中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是( )
A. “千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于分离提纯操作中的“过滤”
B. 司母戊鼎属青铜制品,是我国古代科技光辉成就的代表之一
C. 瓷器(China)属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象
D. 侯德榜是我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
难度: 中等查看答案及解析
-
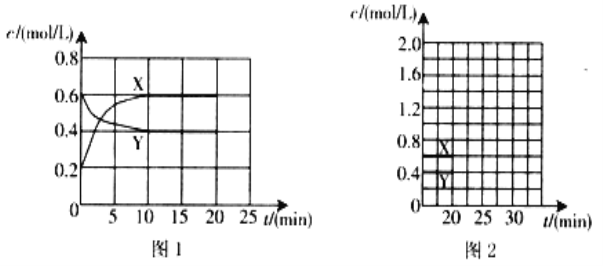
某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:下列有关实验的叙述中,不正确的是
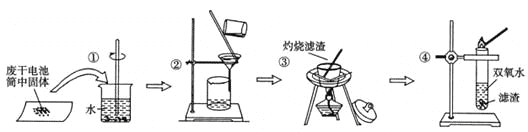
A. 操作①中玻璃棒的作用是加快固体溶解速度
B. 操作②的操作名称是过滤
C. 操作③中盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中杂质
难度: 中等查看答案及解析
-
氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下(以F-12 (二氯二氟甲烷)为例):
CF2Cl2
CF2Cl+Cl Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯) ClOOCl
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率 B. ClO +ClO
ClOOC1的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂 D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
难度: 简单查看答案及解析
-
有机化合物环丙叉环丙烷,由于其特殊的电子结构一直受到理论化学家的注意,如图是它的结构示意图。下列关于环丙叉环丙烷的有关说法中错误的是( )
A. 环丙叉环丙烷的二氯取代物有4种 B. 环丙叉环丙烷不是环丙烷的同系物
C. 环丙叉环丙烷所有的原子均在同一平面内 D. 环丙叉环丙烷与环己二烯互为同分异构体
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 已知冰的熔化热为6.0 kJ • mol-1,冰中氢键键能为20 kJ • mol-1,假设1 mol 冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15 %的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a, 电离常数
。若加水稀释,则CH3COOH
CH3C00-+H+向右移动,a增大, Ka不变
C. 甲烷的标准燃烧热为-890.3 kJ• mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ • mol-1
D. 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g)△H=-38.6kJ/mol
难度: 中等查看答案及解析
-
现有室温下四种溶液,有关叙述不正确的是
编号
①
②
③
④
pH
10
10
4
4
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
难度: 中等查看答案及解析
-
A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是
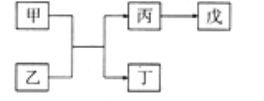
A. C、D两元素形成化合物属共价化合物
B. C. D的简单离子均能促进水的电离
C. A、D分别与B 元素形成的化合物都是大气污染物
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
难度: 困难查看答案及解析
-
宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是

A. 青铜器发生电化学腐蚀,图中c作负极,被氧化
B. 正极发生的电极反应为O2+ 4e-+2H2O=4OH-
C. 环境中的Cl- 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓
D. 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L
难度: 困难查看答案及解析
-
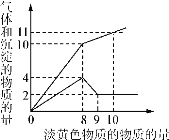
25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH) + c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH 的关系如图所示。

下列说法正确的是
A. 丙酸的酸性比甲酸强
B. CH3CH2COOH
CH3CH2COO-+ H+ 的lgK=-4.88
C. 若0.1mol/L 甲酸溶液的pH=2.33,则0.01mol/L 甲酸溶液的pH=3.33
D. 将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c (HCOO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
t℃时,AgCl(s)与AgI(s)分别在溶液中达到沉淀溶解平衡,相关离子浓度的关系如下图所示。下列说法正确的是

A. 曲线Y表示
与
的变化关系
B. t℃时,向Z点对应的溶液中加入蒸馏水,可使溶液变为曲线X对应的饱和溶液
C. t℃时,AgCl(s)+I-(aq)
AgI(s)+Cl-(aq)的平衡常数K=1×103
D. t℃时,向浓度均为0.1mol/ L的KI与KCl混合溶液中加入AgNO3 溶液,当Cl-刚好完全沉淀时,此时c(I-) = 1×10-11 mol/L
难度: 中等查看答案及解析
-
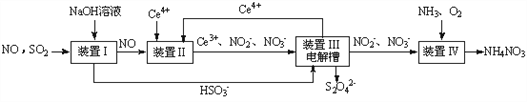
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知转化过程中的反应为2CrO42-(aq)+2H+(aq)
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
难度: 简单查看答案及解析
-
已知:RCH2OH
RCHO
RCOOH
某有机物X的化学式为C6H14O,能和钠反应放出氢气。X经酸性重铬酸钾(K2Cr2O7)溶液氧化最终生成Y(C6H12O2),若不考虑立体结构。X和Y在一定条件下生成酯最多有
A.4种
B.8种
C.32种
D.64种
难度: 困难查看答案及解析
-
(题文)500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO3-)=6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体22.4 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(Na+)=6 mol·L-1 B. 电解后溶液中c(H+)=4 mol·L-1
C. 上述电解过程中共转移8 mol电子 D. 电解后得到的Cu的物质的量为2 mol
难度: 中等查看答案及解析
-
某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
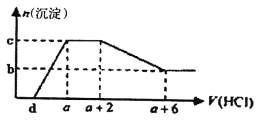
A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
难度: 困难查看答案及解析