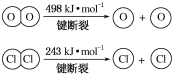
-
下列有关化学反应速率的说法中,正确的是( )
A. 100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的NaCl溶液,生成H2的速率不变
B. 用铁片和稀硫酸反应制取H2时,改用铁片和浓硫酸可以加快产生H2的速率
C. 二氧化硫的催化氧化反应是一个放热反应,所以升高温度,反应速率减慢
D. 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
难度: 中等查看答案及解析
-
(题文)工业生产水煤气的反应为C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.4 kJ·mol-1,下列判断正确的是( )
A. 反应物的总能量大于生成物的总能量
B. CO(g)+H2(g)===C(s)+H2O(l) ΔH=-131.4 kJ·mol-1
C. 该反应中生成1 mol H2(g)吸收131.4 kJ的热量
D. 该反应中生成1体积CO(g)吸收131.4 kJ的热量
难度: 中等查看答案及解析
-
下列说法错误的是( )
①化学反应除了生成新物质外,还伴随着能量的变化
②需要加热才能发生的化学反应一定是吸热反应
③活化分子间的碰撞一定是有效碰撞
④化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量的相对大小
⑤反应物的总能量高于生成物的总能量时,发生放热反应
⑥任何化学反应都有反应热
⑦化学反应中的能量变化都表现为热量的变化
A. ①②③④⑤⑥ B. ②③
C. ②③⑦ D. ①④⑤⑥
难度: 中等查看答案及解析
-
胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A. 2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
B. CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
C. CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D. CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
难度: 简单查看答案及解析
-
已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A.2H2(g)+O2(g)===2H2O(g) ΔH=+483.6 kJ/mol
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为: NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol
D.己知2C(s)+2O2(g)==2CO2(g) ΔH1 2C(s)+O2(g)==2CO(g) ΔH2,则ΔH1>ΔH2
难度: 中等查看答案及解析
-
0.096 kg碳完全燃烧可放出3 147.9 kJ的热量 ,则下列热化学方程式正确的是( )
A. C+O2===CO2 ΔH=-393.49 kJ·mol-1
B. C(s)+O2(g)===CO2(g) ΔH=+393.49 kJ·mol-1
C. C(s)+O2(g)===CO2(g) ΔH=-393.49 kJ·mol-1
D. C(s)+1/2O2(g)===CO(g) ΔH=-393.49 kJ·mol-1
难度: 简单查看答案及解析
-
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(kJ)是
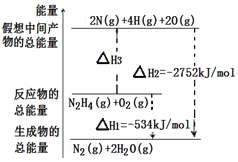
A. 194 B. 391 C. 516 D. 658
难度: 困难查看答案及解析
-
如图所示为800 oC时A、B、C三种气体在密闭容器中反应时浓度的变化,分析图像得出的结论错误的是( )
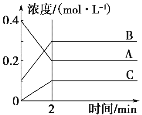
A. A是反应物
B. 前2 min A的反应速率为0.1 mol·L-1·min-1
C. 2min后反应达到平衡,v(A)正 = v(C)逆
D. 反应的方程式为2A(g)
2B(g)+C(g)
难度: 中等查看答案及解析
-
一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g)
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2
D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
难度: 简单查看答案及解析
-
在298 K、101 kPa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=(4x-y) kJ·mol-1
C. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=(2y-x) kJ·mol-1
难度: 中等查看答案及解析