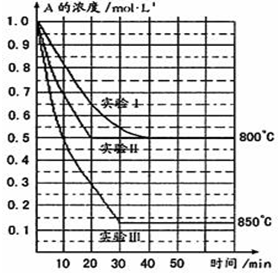
-
在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:A(s)+2B(g)⇌C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强
B.混合气体的密度
C.A的密度
D.气体总物质的量难度: 中等查看答案及解析
-
对于反应中的能量变化,表述正确的是( )
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.氧化反应均为吸热反应难度: 中等查看答案及解析
-
已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol,则反应HCl(g)═
H2(g)+
Cl2(g)的△H为( )
A.+184.6kJ/mol
B.-92.3kJ/mol
C.-369.2kJ/mol
D.+92.3kJ/mol难度: 中等查看答案及解析
-
下列热化学方程式中的△H能表示物质燃烧热的是( )
A.2 CO(g)+O2(g)=2 CO2(g);△H=-566 KJ•mol-1
B.CH4(g)+2 O2(g)=CO2(g)+2 H2O(l);△H=-890 KJ•mol-1
C.2 H2(g)+O2(g)=2 H2O(l);△H=-571.6 KJ•mol-1
D.H2(g)+Cl2(g)=2 HCl(g);△H=-184.6 KJ•mol-1难度: 中等查看答案及解析
-
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=-Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3
B.Q1>Q3>Q2
C.Q3>Q2>Q1
D.Q2>Q1>Q3难度: 中等查看答案及解析
-
在2A+B═3C+4D反应中,表示该反应速率最快的是( )
A.υ(B)=0.3 mol•-1
B.υ(A)=0.5 mol•-1
C.υ(C)=0.8 mol•-1
D.υ(D)=1 mol•-1难度: 中等查看答案及解析
-
已知:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-25kJ/mol
某温度下的平衡常数为400.此温度下,在1L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
下列说法正确的是( )物质 CH3OH CH3OCH3 H2O c/ 0.8 1.24 1.24
A.平衡后升高温度,平衡常数>400
B.平衡时,c(CH3OCH3)=1.6 mol/L
C.平衡时,反应混合物的总能量减少20 kJ
D.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大难度: 中等查看答案及解析
-
把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示.下列因素中,影响反应速率的因素是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度④Cl-的浓度.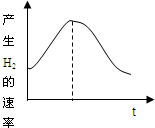
A.①④
B.③④
C.①②③
D.②③难度: 中等查看答案及解析
-
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l)⇌2PbCrO4(s)+2H+(aq)△H<0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应2NO(g)+2CO(g)⇌N2 (g)+2CO2 (g)△H<O,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强难度: 中等查看答案及解析
-
已知一定温度下合成氨反应:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,在恒温恒压的密闭容器中进行如下实验:①通入1mol N2和3mol H2,达平衡时放出热量为Q1,②通入2mol N2和6mol H2,达平衡时放出热量为Q2,则下列关系正确的是( )
A.Q2=2 Q1
B.Q1<0.5 Q2
C.Q1<Q2<184.8 kJ
D.Q1=Q2<92.4 kJ难度: 中等查看答案及解析
-
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后测得C的浓度为0.6mol•L-1,下列几种说法错误的是( )
A.用物质A表示的反应平均速率为0.3 mol•L-1•s-1
B.2 s时物质A的转化率为70%
C.用物质B表示的反应的平均速率为0.6 mol•L-1•s-1
D.2 s时物质B的浓度为0.7 mol•L-1难度: 中等查看答案及解析
-
反应4NH3+5O2⇌4NO+6H2O在5L的密闭容器中进行30s后,NO的物质的量增加了0.3mol,则此反应的平均速率为( )
A.v(O2)=0.01 mol•L-1•s-1
B.v(NO)=0.008 mol•L-1•s-1
C.v(H2O)=0.003 mol•L-1•s-1
D.v(NH3)=0.002 mol•L-1•s-1难度: 中等查看答案及解析
-
反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入氮气使体系压强增大
D.保持压强不变,充入氮气使容器体积增大难度: 中等查看答案及解析
-
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)
2C(g);
△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )X Y A 再加入A B的转化率 B 再加入C A的转化率 C 增大压强 A的质量分数 D 升高温度 混合气体平均摩尔质量
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
某温度下,N2O4(g)⇌2NO2(g);△H>0.在密闭容器中达到平衡,下列说法不正确的是( )
A.加压时(减小体积),将使正、逆反应速率增大,平衡向逆反应方向移动
B.保持体积不变,加入少许NO2,将使正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深
D.保持体积不变,降低温度,再达平衡时颜色变深难度: 中等查看答案及解析
-
将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)⇌2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
A.1.6 mol SO2+0.3 mol O2+0.4 mol SO3
B.4.0 mol SO2+1.0 mol O2
C.2.0 mol SO2+1.0 mol O2+2.0 mol SO3
D.3.0 mol SO2+0.5 mol O2+1.0 mol SO3难度: 中等查看答案及解析