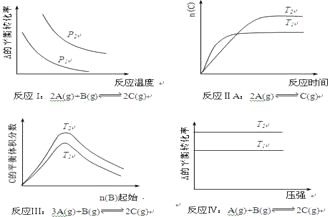
-
下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是



A.甲醇低温所制氢气用于新能源汽车
B.氘、氚用作“人造太阳”核聚变燃料
C.偏二甲肼用作发射“天宫二号”的火箭燃料
D.开采可燃冰,将其作为能源使用
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ。油酸甘油酯的燃烧热△H为
A. 3.8×104kJ·mol-1 B. -3.8×104kJ·mol-1
C. 3.4×104kJ·mol-1 D. -3.4×104kJ·mol-1
难度: 简单查看答案及解析
-
据人民网2001年9月4日报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:2H2O
2H2↑+O2↑。有下列几种说法:① 水分解反应是放热反应;② 氢气是一次能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是
A. ①② B. ②③ C. ③④ D. ①②③④
难度: 简单查看答案及解析
-
下列关于说法正确的是
A. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和在点燃条件下的△H不同
B. CO(g)的燃烧热△H =-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol
C. 热化学方程式未注明温度和压强时,△H表示标准状况下的数据
D. 在加热或点燃条件下才能进行的化学反应一定为吸热反应
难度: 简单查看答案及解析
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是
A. 反应I在较低的温度下可自发进行
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g)
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)
CaO(s)+SO3(g)的焓变
难度: 简单查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
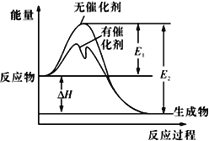
A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂可以加快反应速率
难度: 简单查看答案及解析
-
美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000 K,成功观察到CO与O形成化学键生成CO2的全过程。下列说法不正确的是
A. CO2属于非电解质
B. CO与O形成化学键的过程中放出能量
C. 钌催化剂可以改变该反应的焓变
D. CO与O形成化学键的过程中有电子转移
难度: 简单查看答案及解析
-
反应N2(g)+3H2(g)
2NH3(g) △H<0,若在恒压绝热的容器中发生,下列选项表明一定已达平衡状态的是
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开H-H键的数目和生成N-H键的数目相等
D. 容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于2HI(g)
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
难度: 简单查看答案及解析
-
在恒温时,一固定容积的容器内发生如下反应:2NO2(g)
N2O4(g),达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后与第一次平衡时相比,下列说法正确的是
A. NO2的体积分数减小 B. NO2的转化率减小
C. 化学反应速率不变 D. 气体的平均相对分子质量减小
难度: 中等查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
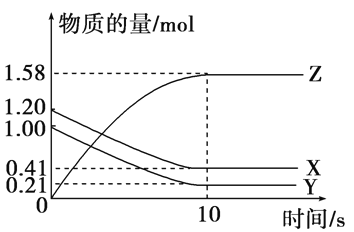
下列描述正确的是( )
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1
B. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C. 反应开始到10 s时,Y的转化率为79.0%
D. 反应的化学方程式为X(g)+Y(g)
Z(g)
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g),平衡时测得C的浓度为0.50mol/L。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得C的浓度变为0.90mol/L。下列有关判断正确的是
A. C的体积分数增大了
B. A的转化率降低了
C. 平衡向正反应方向移动
D. x+y>z
难度: 困难查看答案及解析
-
将BaO2放入密闭真空容器中,反应2BaO2(s)
2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同 ( )
A. 保持体积和温度不变,充入一定量的氧气 B. 保持温度不变,缩小容器的体积
C. 保持体积不变,升高温度 D. 保持体积和温度不变,加入BaO2
难度: 困难查看答案及解析
-
已知A(?)+aB(g)
C(g)+2D(g)(a为正整数).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法错误的是
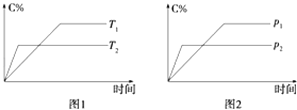
A. 若a=2,则A为液态或固体 B. 该反应的正反应为放热反应
C. T2>T1,P2>P1 D. 增加B的物质的量,平衡正移,平衡常数K增大
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
难度: 困难查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g)
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
难度: 中等查看答案及解析
-
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)
2C(g);ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
X
Y
A
再加入B
B的转化率
B
再加入C
A的体积分数
C
增大压强
A的转化率
D
升高温度
混合气体平均摩尔质量
难度: 简单查看答案及解析
-
一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1
容器2
容器3
反应温度T/K
700
700
800
反应物投入量
2molSO2、1molO2
4molSO3
2molSO2、1molO2
平衡v正(SO2)/mol·L-1·s-1
v1
v2
v3
平衡c(SO3)/mol·L-1
c1
c2
c3
平衡体系总压强p/Pa
p1
p2
p3
物质的平衡转化率a
α1 (SO2)
α2 (SO3)
α3 (SO2)
平衡常数K
K1
K2
K3
下列说法正确的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) <α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
难度: 中等查看答案及解析