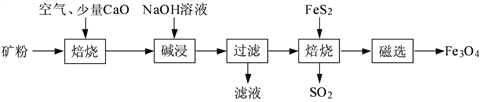
-
下列有关物质性质与用途具有对应关系的是
A. NaHCO3受热易分解,可用于制胃酸中和剂
B. SiO2熔点高硬度大,可用于制光导纤维
C. Al2O3是两性氧化物,可用作耐高温材料
D. CaO能与水反应,可用作食品干燥剂
难度: 中等查看答案及解析
-
某同学通过系列实验探究Cu及其化合物的性质,操作正确且能达到目的的是
A. 将铜粉与硫粉混合均匀加热以制取CuS
B. 向Cu与过量浓硫酸反应后的试管中加水以观察CuSO4溶液的颜色
C. 向CuSO4溶液中加入过量的NaOH,过滤洗涤并收集沉淀充分灼烧以制取CuO
D. 在淀粉溶液中加入适量稀H2SO4微热,再加少量新制Cu(OH)2悬浊液并加热,产生红色沉淀
难度: 困难查看答案及解析
-
FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A. 加入KSCN溶液一定不变红色
B. 溶液中一定含Fe2+
C. 溶液中一定不含Cu2+
D. 剩余固体中一定含Cu
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. Na2O2、Na2O均能吸收CO2并放出氧气
B. Mg、A1、Fe均能在冷的浓硝酸中钝化
C. SO2和C12的漂白原理相同
D. SiO2既能与NaOH又能与Na2CO3反应生成Na2SiO3
难度: 中等查看答案及解析
-
向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A. 碳酸钙粉末 B. 稀硫酸 C. 氯化钙溶液 D. 二氧化硫水溶液
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下不能实现的是( )
A. 饱和NaCl(aq)
NaHCO3
Na2CO3
B. MgCl2(aq)
Mg(OH)2
MgO
C. Al2O3
NaAlO2(aq)
Al(OH)3
D. Fe2O3
FeCl3(aq)
无水FeCl3
难度: 简单查看答案及解析
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Cu2+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
将过量CO2分别通入:①CaCl2溶液,②Na2SiO3溶液,③Ca(OH)2溶液,④饱和Na2CO3溶液,⑤NaAlO2,⑥C6H5ONa,最终溶液变浑浊的是( )
A. ①②⑤⑥ B. ②④⑤⑥ C. ①②③⑤ D. ②③④⑥
难度: 中等查看答案及解析
-
下列说法错误的是( )。
①向NaClO溶液中滴入少量FeSO4溶液,反应的离子方程式为2Fe2++ClO-+2H+
Cl-+2Fe3++H2O
②向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液,溶液变成血红色,说明Fe2+既有氧化性又有还原性
③将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,有气体生成,溶液呈血红色,则稀硝酸将Fe氧化成了Fe3+
④向某溶液中滴加氯水后再加入KSCN溶液,若溶液呈红色,则溶液中一定含有Fe2+
⑤在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
A. ①②③④ B. ①②③④⑤
C. ②③④ D. ②③④⑤
难度: 中等查看答案及解析
-
将CO2气体缓缓地通入含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物 质的量与所通CO2的体积关系如图所示。下列关于整个反应过程中的描述不正确的是
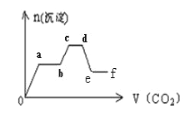
A. O~a段反应的化学方程式是Ba(OH)2+CO2
BaCO3↓+H2O
B. a~b段反应的离子方程式是2OH-+CO2
CO32-+H2O
C. a~b段与c~d段所发生的反应相同
D. d~e段沉淀减少是由于碳酸钡固体溶解
难度: 困难查看答案及解析
-
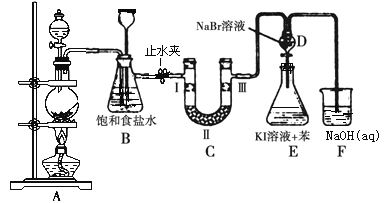
某小组设计如图所示装置(夹持装置略去),在实验室模拟侯氏制碱工艺中NaHCO3的制备。下列说法不正确的是( )

A. ③、⑤中可分别盛放饱和食盐水和浓氨水
B. 应先向③中通入足量NH3,再通入足量CO2
C. ③中反应的离子方程式为NH3+CO2+H2O=NH4++HCO3-
D. 装置①也可用于制H2
难度: 中等查看答案及解析