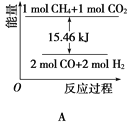
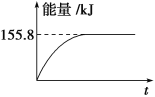
-
下列说法中有明显错误的是
A. 对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B. 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C. 活化分子之间发生的碰撞一定为有效碰撞
D. 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
难度: 中等查看答案及解析
-
向足量H2SO4溶液中加入100mL 0.4mol•L﹣1Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol•L﹣1HCl溶液时,放出的热量为2.2kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A. Ba2+(aq)+SO42﹣(aq)=BaSO4(s)△H=﹣2.92kJ•mol﹣1
B. Ba2+(aq)+SO42﹣(aq)=BaSO4(s)△H=﹣0.72kJ•mol﹣1
C. Ba2+(aq)+SO42﹣(aq)=BaSO4(s)△H=﹣73kJ•mol﹣1
D. Ba2+(aq)+SO42﹣(aq)=BaSO4(s)△H=﹣18kJ•mol﹣1
难度: 中等查看答案及解析
-
同温同压下,已知下列各反应为放热反应,下列各热化学方程式中ΔH最小的是
A. 2A(l)+B(l)==="2C(g)" ΔH1 B. 2A(g)+B(g)==="2C(l)"ΔH2
C. 2A(g)+B(g)==="2C(g)" ΔH3 D. 2A(l)+B(l)==="2C(l)" ΔH4
难度: 中等查看答案及解析
-
下列关于能量变化的说法正确的是
A. “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B. 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C. 已知C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定
D. 化学反应遵循质量守恒的同时,也遵循能量守恒
难度: 中等查看答案及解析
-
全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是( )
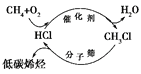
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 上图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想
D. 让煤变成水煤气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
难度: 简单查看答案及解析
-
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A. CO(g)+1/2O2(g)=CO2(g) ΔH=—283.0kJ/mol
B. C(s) + 1/2O2(g)=CO(g) ΔH=—110.5kJ/mol
C. H2+ 1/2O2(g)=H2O(g) ΔH=—241.8kJ/mol
D. 2C8H18(l)+25O2(g)=6CO2(g)+18H2O(l) ΔH=—11036kJ/mol
难度: 简单查看答案及解析
-
中和热的数值是57.3kJ/mol。下列酸、碱溶液混合产生的热量等于57.3kJ的是( )
A. 1mol/L的稀HCl溶液与1mol/L的稀NaOH溶液
B. 1mol/L的稀H2SO4溶液与1mol/L的稀NaOH溶液
C. 1L 1mol/L的稀HCl溶液与1L 1mol/L的稀NaOH溶液
D. 1L 1mol/L的稀H2SO4溶液与1L 1mol/L的稀Ba(OH)2溶液
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下的反应速率分别如下,其中反应速率最大的是
A. VA=0.15mol•L-1•min-1 B. VB=0.6mol•L-1•min-1
C. VC=0.4mol•L-1•min-1 D. VD=0.01mol•L-1•s-1
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A. ①④ B. ②③ C. ①③ D. ②④
难度: 困难查看答案及解析
-
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似,已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则下列说法不正确的是( )

A. N4与N2互为同素异形体 B. 1molN4气体转化为N2时要放出724kJ能量
C. N4变成N2是化学变化 D. N4与N2互为同位素
难度: 简单查看答案及解析
-
如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况
,则所发生反应的化学方程式是( )
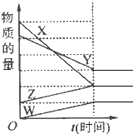
A. 4x+2y
z+w B. 6x+5y
4z+w
C. 3w+z
4x+2y D. 2x+y
2z+2w
难度: 中等查看答案及解析
-
根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
1/2N2(g)+3/2H2(g)=NH3(g) ΔH=-46.19 kJ·mol—1
1/2H2(g)+1/2Cl2(g)=HCl(g) ΔH=-92.36 kJ·mol—1
1/2I2(g)+1/2H2(g)=HI(g) ΔH=+25.96 kJ·mol—1
A. HI>HCl>NH3 B. HCl>NH3>HI C. HCl>HI>NH3 D. NH3>HI>HCl
难度: 简单查看答案及解析
-
反应 A + B→C + Q分两步进行 ①A + B→X - Q;②X→C + Q。下列示意图中,能正确表示总反应过程中能量变化的是

A
B
C
D
难度: 简单查看答案及解析
-
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
A. 2FeCO3(s)+1/2 O2(g)=Fe2O3(s)+2CO2(g) ΔH =—130kJ·mol
B. 4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ΔH =+260kJ·mol-1
C. 4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ΔH =—260kJ·mol-1
D. 4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ΔH =+130kJ·mol-1
难度: 简单查看答案及解析
-
S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) ="=" SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) ="=" SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) ="=" S(正交,s) △H3
下列说法正确的是( )
A. △H3=+0.33 kJ·mol-1
B. 单斜硫转化为正交硫的反应是吸热反应
C. S(单斜,s) ="=" S(正交,s) △H3<0,正交硫比单斜硫稳定
D. S(单斜,s) ="=" S(正交,s) △H3>0,单斜硫比正交硫稳定
难度: 中等查看答案及解析
-
已知充分燃烧一定量的丁烷(C4H10)气体生成液态水时,放出的热量为QkJ,而生成的CO2恰好被200mL 5mol/L KOH溶液吸收生成正盐,则丁烷的燃烧热ΔH为( )
A. —8Q kJ/mol B. —4Q kJ/mol C. —20Q kJ/mol D. —16Q kJ/mol
难度: 简单查看答案及解析