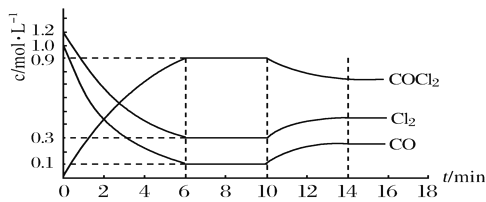
-
下列实验操作、实验现象和实验结论均正确的是
A. 向待测溶液中先滴加几滴氯水,然后滴加KSCN溶液,溶液变红,待测溶液中含有Fe2+
B. 向某盐溶液中滴加浓NaOH溶液,加热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝,说明该溶液中含有NH4+
C. 向AgNO3溶液中滴加过量氨水,得到澄清溶液,Ag+与NH3·H2O能大量共存
D. 向某溶液中加入硝酸酸化的BaCl2溶液,出现白色沉淀,说明该溶液中一定含有SO42-
难度: 中等查看答案及解析
-
纵观古今,化学与生活皆有着密切联系。下列说法错误的是( )
A. 《本草图经》在绿矾项载:“盖此矾色绿,味酸,烧之则赤…”。因为绿矾能电离出H+,所以有“味酸”.
B. 《天工开物》记载:“凡白土曰垩土,为陶家精美器用”。陶是一种传统硅酸盐材料
C. “水声冰下咽,沙路雪中平”描述的是水的三态变化:“冰,水为之,而寒于水”,说明冰转化为水吸热
D. 唐未《真元妙道要略)中有云:“以硫黄、雄黄合硝石并蜜烧之;焰起,烧手面及烬屋舍者”,文中描述的是黑火药的制作过程
难度: 中等查看答案及解析
-
下列关于有机化合物的叙述正确的是( )
A. 已知氟利昂12的结构式为
,该分子是平面形分子
B. 1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应
C. 用甲苯分别制取TNT、邻溴甲苯所涉及的反应均为取代反应
D.
的一氯代物共有5种(不考虑立体异构)
难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数的值,下列叙述正确的是
A. 0.1L 0.5mol/L CH3COOH溶液中含有的氢离子数为0.05NA
B. 常温下,0.5 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为1NA
C. 22.4 L(标准状况)氩气含有的质子数为18NA
D. 标准状况下,4.48 L CCl4含有的共价键数为0.8NA
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. Na2O2与水反应制氧气:2O2- + 2H2O = 4OH- + O2↑
B. 向Na2CO3(aq)中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32- + 2H+ = HCO3-
C. 在100mL 1mol·L-1 Fe(NO3)3(aq)中通入足量SO2:2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+
D. 1mol·L-1的NaAlO2(aq)和2.5mol·L-1的盐酸等体积混合:2AlO2- + 5H+ = Al(OH)3↓+ Al3+ + H2O
难度: 中等查看答案及解析
-
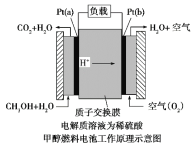
十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
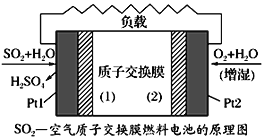
A. 该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B. Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
C. Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
难度: 中等查看答案及解析
-
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法中正确的是
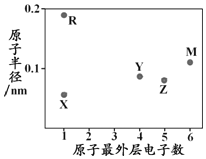
A. 简单离子半径:R>M
B. M和Z两种元素可以共存于同一种离子化合物中
C. 工业冶炼R的单质通常用热还原法
D. 氧化物的水化物酸性:Z<M
难度: 中等查看答案及解析