-
从安全的角度,下列说法正确的是
A.水银温度计不慎打破,用胶头滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉的广口瓶中
B.用氢气还原氧化铜的实验中,开始应该先点燃酒精灯后通氢气
C.遇到氯气泄漏时,应立即关闭氯气罐,用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
D.乘坐火车时,严禁携带白磷、汽油、氯化钠等易燃易爆物品
难度: 中等查看答案及解析
-
用下列分离装置进行相应实验,能达到相应实验目的的是( )
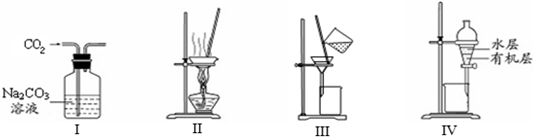
A.用图I除去CO2中含有的少量Cl2
B.用图Ⅱ蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图Ⅲ分离NaCl和Na2SO4的混合溶液
D.用图Ⅳ分离CCl4萃取碘水中的碘后已分层的有机层和水层
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
B.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
C.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
难度: 中等查看答案及解析
-
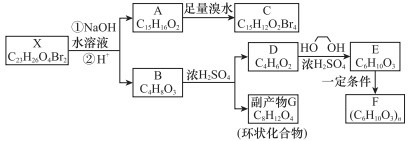
塑化剂(DCHP)常用于塑料加工,其中一种制备方法如下:
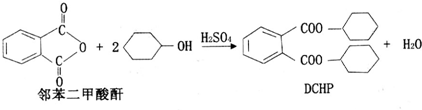
下列说法正确的是( )
A.DCHP的分子式为C20H28O4
B.上述制备DCHP的反应属于取代反应
C.DCHP苯环上的一氯代物有4种
D.1molDCHP最多可与含4molNaOH的溶液反应
难度: 中等查看答案及解析
-
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是( )
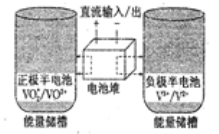
A.放电时,右槽发生还原反应
B.放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C.充电时,每转移1mol电子,n(H+)的变化量为1mol
D.充电时,阴极电解液pH升高
难度: 中等查看答案及解析
-
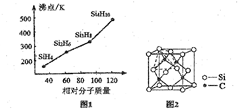
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
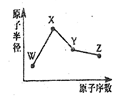
A.对应简单离子半径:W>X
B.对应气态氢化物的稳定性:Y<Z
C.化合物XZW既含离子键,又含极性共价键
D.Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
难度: 中等查看答案及解析
-
某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3·H2O、NaCl四种溶液,按图所示步骤分开五种离子。下列判断正确的是

A.沉淀乙是氢氧化铝和氢氧化银的混合物
B.溶液3中含有Al3+
C.试剂①是NaCl,试剂④是H2SO4
D.溶液4含有三种阳离子,分别是H+、Na+、K+
难度: 困难查看答案及解析