-
下列有关原子结构的说法,正确的是( )
A. 决定元素种类的是—电子数
B. 决定元素化学性质的是—原子的核外电子数
C. 决定元素相对原子质量的是—中子数
D. 决定元素周期表中原子序数的是—核电荷数
难度: 简单查看答案及解析
-
元素周期表从第一周期到第六周期所能容纳元素的种类分别为2、8、8、18、18、32,对于第37号元素,如下各项描述正确的是( )
A. 该元素的单质在常温下跟酸反应缓慢
B. 该元素的原子半径在同周期的主族元素中最小
C. 该元素的碳酸盐难溶于水
D. 该元素的最高价氧化物的水化物能使Al(OH)3溶解
难度: 简单查看答案及解析
-
下列有关原子或离子的结构示意图表示正确的是( )
A.
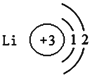 B.
B. 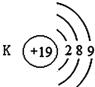 C.
C. 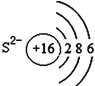 D.
D. 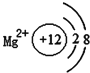
难度: 简单查看答案及解析
-
下列叙述错误的是( )
A. AZRn-有x个电子,则w克Rn-含有的中子数为
B. 3517Cl和3717Cl互称同素异形体
C. D216O中,质量数之和是质子数之和的两倍
D. 在18g18O2中含有NA个氧原子
难度: 简单查看答案及解析
-
日本大地震引发的福岛第一核电站核泄漏事故,造成放射性物质碘-133和铯-137(13755Cs)向外泄漏。下列相关说法错误的是( )
A. 每个13755Cs原子中有82个中子
B. CsOH的碱性比KOH强
C. KIO3是碘的最高价氧化物的水化物的盐
D. HI比HF还原性强
难度: 简单查看答案及解析
-
下列能说明氯元素比硫元素非金属性强的是( )
①HCl比H2S稳定;②HClO4酸性比H2SO4强;③Cl2能与H2S反应生成S;④Cl原子最外层有7个电子,S原子最外层有6个电子;⑤Cl2比S更易与H2化合生成相应气态氢化物;⑥盐酸是强酸,而氢硫酸是弱酸。
A. ①②③④⑤⑥ B. ①②③④⑥ C. ①②③⑤ D. ②④⑥
难度: 困难查看答案及解析
-
已知Se为第四周期第ⅥA族元素,Tl为第六周期第ⅢA族元素,At为第六周期第ⅦA族元素。下列预测中不正确的是( )
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At2单质为有色固体,难溶于水,易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体
A. ①②③④ B. ②④⑥ C. ①③⑤ D. ②④⑤
难度: 中等查看答案及解析
-
有M、N、P、Q四块金属片,进行如下实验:
①M、N用导线相连后,同时插入稀H2SO4中,M极为负极
②P、Q用导线相连后,同时浸入稀H2SO4中,电流由电流由Q→导线→P
③M、P相连后,同时浸入稀H2SO4中,P极产生大量气泡
④N、Q相连后,同时浸入稀H2SO4中,Q极发生氧化反应
则四种金属的活动性顺序为( )
A. M>N>P>Q B. M>P>Q>N C. N>Q>P>M D. P>M>N>Q
难度: 中等查看答案及解析
-
已知氢化铵(NH4H)与氯化铵结构相似,且NH4H与水反应有氢气产生,下列叙述中不正确的是( )
A. NH4H是由NH4+和H-构成的
B. NH4H固体投入适量水中,有两种气体产生,形成的溶液显酸性
C. NH4H中的H-半径比锂离子半径大
D. NH4H是一种强还原剂
难度: 简单查看答案及解析
-
aXn-和bYm+为两短周期主族元素的离子,它们的电子层结构相同,下列判断错误的是( )
A. 原子半径X<Y B. a+n=b-m
C. Y最高价氧化物的化学式为YOm D. 原子最外层电子数X>Y
难度: 简单查看答案及解析
-
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A. NH4HCO3和盐酸的反应是放热反应
B. NH4HCO3和盐酸反应中,热能转化为产物内部的能量
C. 反应物的总能量高于生成物的总能量
D. NH4HCO3只含有共价键
难度: 简单查看答案及解析
-
下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2
难度: 简单查看答案及解析
-
下列反应不可能作为原电池工作时发生的反应的是
A. Cu+2AgNO3===Cu(NO3)2+2Ag
B. 2Fe+O2+2H2O===2Fe(OH)2
C. Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3
+10H2O
D. 2H2+O2===2H2O
难度: 简单查看答案及解析
-
LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
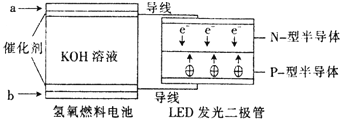
A. a外通入氧气,b处通氢气
B. 通入H2的电极发生反应:H2-2e-=2H+
C. 通入O2的电极发生反应:O2+4e-+2H2O=4OH-
D. 该装置将化学能最终转化为电能
难度: 简单查看答案及解析
-
已知:2P(s)+3Cl2(g)=2PCl3(g) △H1=-612kJ·mol-1,PCl5(g)=PCl3(g)+Cl2(g) △H2=+93kJ·mol-1,则P(s)+5/2Cl2(g)=PCl5(g)的△H是( )
A. -705kJ·mol-1 B. -399kJ·mol-1
C. +203kJ·mol-1 D. -213kJ·mol-1
难度: 简单查看答案及解析
-
已知Te为第五周期第ⅥA族元素。下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>H2SiO3
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A. ②⑤⑦ B. ②④⑥ C. ②④⑤⑥⑦ D. ②⑥⑦
难度: 中等查看答案及解析
-
类比推理的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论。以下几个类比推理结论中正确的是( )
A. NH3的沸点高于PH3,推出CH4的沸点高于SiH4
B. 卤素单质的熔沸点随相对分子质量的增加而增大,推出NaF、NaCl、NaBr、NaI的熔沸点随式量的增加面增大
C. CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成
D. 硫元素的非金属性较强,其最高价含氧酸H2SO4为强酸,推出HClO4为强酸
难度: 中等查看答案及解析
-
以下各组物质在发生相应变化时所克服的微粒间作用力完全相同的是( )
A. 干冰升华和液溴挥发
B. 金刚石熔化和硫磺(S8)熔化
C. 硝酸钾溶于水和H2SO4溶于水
D. KHSO4熔融和HI分解
难度: 简单查看答案及解析
-
化学反应的本质是旧健的断裂和新健的形成过程,化学键的键能是形成(或拆开)1mol化学键进释放(或吸收)的能量。已知白磷(P4)和P4O6分子结构如下图所示,现提供以下化学键的键能(kJ/mol)P-P:a,P-O:b,O=O:d(a、b、d均为正数)。则反应P4(白磷)+3O2=P4O6的能量变化为( )

A. 吸收(6a-12b)kJ的能量
B. 释放(6a-12b)kJ的能量
C. 释放(12b-6a-3d)kJ的能量
D. 吸收(6a+3d-12b)kJ的能量
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是( )
A. HW是同主族沸点最高的氢化物
B. X与W形成的化合物和Z与W形成的化合物的化学键类型相同
C. Y离子的半径比Z离子的半径小
D. 元素W的最高价氧化物对应水化物的酸性比Y强
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
M
R
Q
U
原子半径(
10-10m)
1.86
0.99
1.43
1.60
0.75
0.74
0.82
主要化合价
最高正价
+1
+7
+3
+2
+5
+3
最低负价
-1
-3
-2
下列说法错误的是( )
A. 元素X和Q形成的化合物中不可能含有共价键
B. X、Z、R的最高价氧化物的水化物之间可两两相互反应
C. R3-比Q2-更容易失去电子
D. M(OH)2的碱性比XOH的碱性弱
难度: 简单查看答案及解析
-
已知1~18号元素的离子aX m+、bY n+、cZP-、dWk-都具有相同的电子层结构,下列关系正确的是 ( )
A. 若P > K,则还原性cZP- <dWk-
B. 若m > n, 则碱性 X(OH)m > Y(OH)n
C. 若半径aX m+ > bY n+ ,则X的单质一定能从含Y n+ 的盐溶液中置换出Y
D. 若半径aX m+> bY n+ ,则a < b
难度: 困难查看答案及解析
-
目前汽车上使用的电瓶大多仍是铅蓄电池,其构造示意图如下。发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l),下列说法不正确的是
A. 放电时,电解质溶液的pH值增大
B. 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g
C. 放电时,溶液中H+向PbO2电极移动
D. 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
难度: 简单查看答案及解析
-
燃料电池在工作时,不断从外界输入还原剂、氧化剂,同时将电极反应产物不断排出电池。下面4种燃料电池的工作原理示意图,其中正极的反应产物为水的是( )
A. 固体氧化物燃料电池
 B. 碱性燃料电池
B. 碱性燃料电池 C. 质子交换膜燃料电池
C. 质子交换膜燃料电池 D. 熔融盐燃料电池
D. 熔融盐燃料电池
难度: 困难查看答案及解析
-
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是
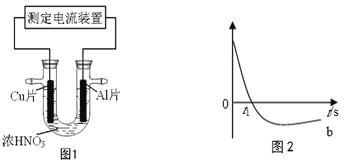
A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
难度: 困难查看答案及解析