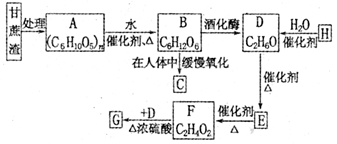
-
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.14C可用于文物的年代的鉴定,12C和14C互为同位素
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
难度: 中等查看答案及解析
-
根据有关概念,推断下列说法中正确的是( )
A.NaCl发生状态变化时,一定会破坏离子键
B.元素的非金属性越强,单质的活泼性一定越强
C.物质中分子间的作用力越大,分子越稳定
D.只含有共价键的物质一定是共价化合物
难度: 中等查看答案及解析
-
暖宝宝(如图所示)采用的是铁的“氧化放热”原理,使其发生原电池反应,铁粉在原电池中充当

A.负极 B.正极
C.阴极 D.阳极
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
难度: 中等查看答案及解析
-
下列叙述不正确的是 ( )
①热稳定性:H2O>HF>H2S ②熔点:Al>Na>K ③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 ④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 ⑤沸点:NH3<PH3<AsH3
A. ①②⑤ B. ①③④ C. ①②③⑤ D. ①③⑤
难度: 中等查看答案及解析
-
关于如右图所示的原电池,下列说法正确的是( )。

A.电流从锌电极通过电流表流向铜电极
B.锌电极发生还原反应,铜电极发生氧化反应
C.当有13 g Zn溶解时,外电路中就有0.4 mol电子通过
D.铜电极作正极,发生的电极反应为2H++2e-===H2↑
难度: 中等查看答案及解析
-
中国石油天然气集团在四川发现了中国最大的天然气田,预计储量达7000亿立方米。天然
气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体。下列有关的说法不正确的是( )
A.甲烷与丙烷互为同系物
B.甲烷不能使高锰酸钾酸性溶液褪色
C.乙烷和氯气在光照的条件下可以发生取代反应
D.甲烷、乙烷、丙烷中的化学键都是极性共价键
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.化学反应速率通常用单位时间内反应物或生成物的质量变化来表示
B.化学反应速率的单位由浓度单位决定
C.在反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值
D.用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比
难度: 中等查看答案及解析
-
丁烷的一氯代物共有多少种 ( )
A.3 B.5 C.4 D.2
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.热化学方程式各物质前的化学计量数不表示分子个数,只代表物质的量
B.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据
C.同一化学反应,化学计量数不同,ΔH不同;化学计量数相同而状态不同,ΔH也不相同
D.化学反应过程所吸收或放出的热量与参加反应物质的物质的量成正比
难度: 中等查看答案及解析
-
据研究,若把太阳光变成激光用于分解海水制氢,反应可表示为:
。有下列几种说法:① 水分解反应是放热反应;② 氢气是可再生能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是( )
A.①② B.③④ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
下列能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS。
A. ①②④⑤ B. ①②③⑥ C. ①③⑤⑥ D. ①③④⑥
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A.NH4Cl 固体和Ba(OH)2晶体在常温下混合即可反应,是因为该反应是放热反应
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)的反应热为ΔH =+566.0kJ/mol
C.含1mol Ba(OH)2的溶液和含1molH2SO4的溶液反应放出的热量是中和热
D.1mol CH4燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
今有如下三个热化学方程式:
H2(g)+l/2O2(g)=H2O(g) △H=akJ/mol
H2(g)+l/2O2(g)=H2O(l) △H=bkJ/mol
2H2(g)+O2(g)=2H2O(l) △H=ckJ/mol
关于它们的下列表述正确的是
A. 2b=c B. a、b和c均为正值 C. a=b D. 它们都是吸热反应
难度: 中等查看答案及解析
-
下列表达方式正确的是( )
A.用电子式表示氯化氢分子的形成过程:

B.硫离子结构示意图:
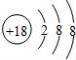
C.氢氧根的电子式:
D.HClO的结构式:H﹣O﹣Cl
难度: 中等查看答案及解析
-
反应:A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A. v(D)=0.40mol/(L·s) B. v(C)=0.50mol/(L·s)
C. v(A)=0.30mol/(L·s) D. v(B)=1.2mol/(L·s)
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. CH3-CH=CH2分子中所有原子一定处于同一平面
B. 除去乙烷中的乙烯是将混和气体通入酸性KMnO4溶液中
C. 若烃中碳、氢元素的质量分数相同,它们可能是同系物
D. 某烷烃的命名为3,4,4-三甲基己烷
难度: 中等查看答案及解析
-
可逆反应2SO2+O2
2SO3达到平衡的标志是( )
①消耗2molSO2的同时生成2molSO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
④恒容条件下压强保持不变
⑤一定体积下气体的密度保持不变
⑥v正(SO2)=2v逆(O2)
A.①②⑤ B.①③④ C.③④ D③④⑥
难度: 简单查看答案及解析
-
在5 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)
N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小
B.反应前5秒钟内,用CO表示的平均反应速率为0.04 mol·L-1·s-1
C.当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变
D.保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变
难度: 简单查看答案及解析
-
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
实验后的记录:
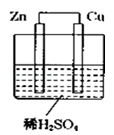
①Zn为正极,Cu为负极
②Cu极上有气泡产生,发生还原反应
③SO42﹣向Zn极移动
④若有0.5mol电子流经导线,则产生5.6L气体
⑤电流的流向是:Cu→Zn
⑥负极反应式:Cu﹣2e﹣═Cu2+,发生氧化反应.
A.②④⑤ B.②③⑤ C.①④⑥ D.③④⑤⑥
难度: 中等查看答案及解析