-
化学已经渗透到人类生活、生产的各个方面,下列说法正确的是
A. PM2.5是指微粒直径大于2.5μm的可吸入悬浮颗粒物
B. 用热的纯碱溶液可以清除炊具上残留的油污
C. 高纯度的硅单质广泛用于光导纤维,光导纤维遇强碱会造成“短路”
D. 明矾常用作净水剂,是因为它能够消毒杀菌
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 丙烯和苯都能使溴水褪色,且褪色的原理相同
B. 油脂和淀粉都属于高分子化合物
C. C4H9C1有4种同分异构体
D. 乙烯使酸性高锰酸钾溶液褪色和乙醇与HBr反应均为取代反应
难度: 简单查看答案及解析
-
(题文)由下列实验及现象不能推出相应结论的是
实验
现象
结论
A
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3固体受热分解,产生的NH3与水反应生成的氨水显碱性
B
向2支盛有1 mL相同浓度AgNO3溶液的试管中分别加入3滴相同浓度的KCl和KI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
C
向苯酚钠溶液中通入CO2
溶液变浑浊
相同条件下,碳酸的酸性一定比苯酚强
D
用铂丝蘸取少量某溶液进行焰色反应
火焰呈黄色
证明该溶液中一定存在Na+和K+
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4LN2和H2混合气中含2NA 个原子
B. 78gNa2O2与足量的CO2完全反应,转移的电子数为2NA
C. 1 L1 mol·L-1NH4Cl溶液中,NH4+的数量为NA
D. 室温下, pH=13的NaOH 溶液中,则溶液中 OH- 离子数目为0.1NA
难度: 中等查看答案及解析
-
某电池以Na2FeO4和Zn为电极材料,NaOH溶液为电解溶质溶液,下列说法正确的是
A. 该电池放电过程中电解质溶液浓度减小
B. 正极反应式为2FeO42−+10H++6e−=Fe2O3+5H2O
C. 电池工作时OH-向负极迁移
D. Zn为电池的正极
难度: 中等查看答案及解析
-
A、B、C是三种短周期元素,A、B位于同一主族,B、C处于同一周期,A 原子的L层电子数比K层多5个,C原子的电子数比B原子少1,说法正确的是
A. 3种元素的气态氢化物中,B的气态氢化物最稳定
B. 元素非金属性由弱到强的顺序是C<B<A
C. 原子半径由大到小的顺序是B>C>A
D. A元素最高价氧化物对应的水化物的化学式可表示为H3AO4
难度: 中等查看答案及解析
-
室温下,用相同浓度的KOH溶液,分别滴定浓度均为0.1 mol·L−1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断正确的是
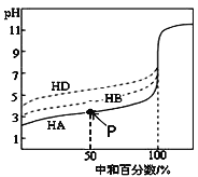
A. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(H+)+c(OH−)
B. 滴定至P点时,溶液中:c(K+)> c(A−)> c(HA)> c(H+)> c(OH−)
C. 同浓度的KA、KB、KD三种盐溶液的pH大小关系:pH(KD)< pH(KB)< pH(KA)
D. 当三种酸都中和至中性时,消耗KOH溶液的体积的大小关系为:V(HA) > V(HB) > V(HD)
难度: 困难查看答案及解析
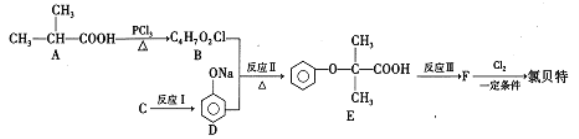
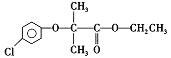 )是临床上一种抗血栓药物.它的一种合成路线如下(图中部分反应条件及部分反应物、生成物已略去)。
)是临床上一种抗血栓药物.它的一种合成路线如下(图中部分反应条件及部分反应物、生成物已略去)。