-
“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是( )
A. 熟石灰 B. 碳酸钾 C. 酒精 D. 烧碱
难度: 简单查看答案及解析
-
正在生长发育的青少年需要大量的蛋白质,为补充优质的蛋白质,应适当地多吃( )
A. 米饭 B. 青菜 C. 瘦肉 D. 水果
难度: 简单查看答案及解析
-
垃圾分类从我做起。金属饮料罐属于( )
A.
 可回收物 B.
可回收物 B.  有害垃圾 C.
有害垃圾 C.  厨余垃圾 D.
厨余垃圾 D.  其他垃圾
其他垃圾难度: 简单查看答案及解析
-
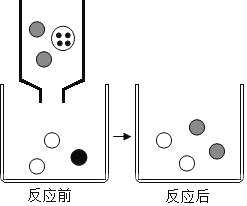
下列属于置换反应的是( )
A. 甲烷燃烧 B. 湿法炼铜
C. 利用CO还原铁矿石炼铁 D. 剧烈运动时肌细胞无氧呼吸
难度: 简单查看答案及解析
-
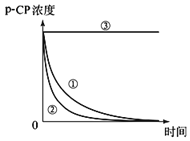
现有盐酸和BaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH变化如图所示。则X可能是( )
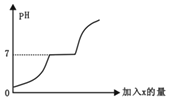
A. 稀硫酸
B. 纯碱溶液
C. 食盐溶液
D. 氢氧化钠溶液
难度: 简单查看答案及解析
-
下列除去杂质的实验设计,可行的是( )
选项
物质
杂质
操作
A
CaO
CaCO3
加入过量的水,过滤
B
盐酸
硫酸
加入过量的BaCl2溶液,过滤
C
NaNO3溶液
NaCl溶液
加入过量的AgNO3溶液,过滤
D
CaCl2溶液
稀盐酸
加入过量的CaCO3粉末,过滤
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
向氧化铜和铁粉的混合物中加入一定量稀硫酸,充分反应后过滤,向滤渣中滴入稀硫酸,有气泡产生。下列判断正确的是( )
A. 滤渣中不可能含有Cu B. 滤渣中不可能只含有Fe
C. 滤液中可能含有
D. 滤液中可能含有
难度: 简单查看答案及解析