-
下列相关离子方程式书写正确的是
A. 泡沫灭火器工作原理:Al3++3HCO3-=Al(OH)3↓+3CO2↑
B. 钠与CuSO4溶液反应:2Na+Cu2+=2Na++Cu
C. 往Ba(OH)2溶液中滴加KHSO4溶液至溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 酸性高锰酸钾溶液与草酸溶液混合:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,22.4LCCl4中含有的共价键数为4Na
B. 0.2mol SO2和0.lmolO2在一定条件下充分反应后,混合物的分子数为0.2NA
C. 常温下,3.2g由S2、S4、S8组成的混合物中含硫原子数为0.1NA
D. 1mol/L Na2CO3溶液中含有CO32-的数目一定小于NA
难度: 困难查看答案及解析
-
下列各组离子在常温下一定能大量共存的是
A. 无色透明的溶液中:Na+、Ba2+、AlO2-、OH-
B. 加入铝粉能放出H2的溶液中:H+、K+、SO42-、Cl-
C. 含有大量Fe3+的溶液中:NH4+、Ca2+、SCN-、Br-
D. pH=0的溶液中:Fe2+、Mg2+、NO3-、SO42-
难度: 困难查看答案及解析
-
有些科学家提出硅是“21世纪的能源”,下列说法正确的是
A. 晶体硅具有半导体性质,可用于生产光导纤维
B. 玻璃中含有的SiO2可与NaOH溶液反应,故常用NaOH溶液雕刻玻璃纹饰
C. 陶瓷、水泥、石英玻璃都属于硅酸盐材料
D. 硅酸盐Na2Fe2Si3O9用氧化物的形式可表示为Na2O·2EeO·3SiO2
难度: 中等查看答案及解析
-
下列有关说法中正确的是
A. 12C、13C、14C是碳的三种同素异行体
B. H2S的电子式可表示为
C. HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D. NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
难度: 困难查看答案及解析
-
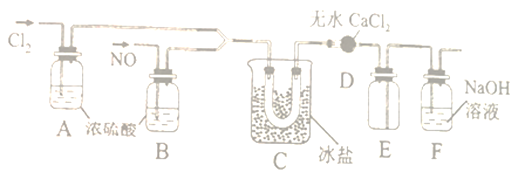
下列装置及其使用说法正确的是
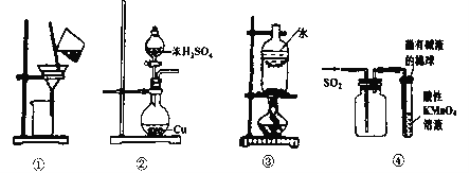
A. 用装置①分离胶体和溶液 B. 用装置②制备SO2
C. 用装置③分离NaCl和I2 D. 用装置④收集SO2并验证其漂白性
难度: 困难查看答案及解析
-
由物质a为原料,制备物质d (金刚烷)的合成路线如下图所示:

关于以上有机物说法中错误的是
A. 物质a的分子式为C5H6
B. 物质b使酸性高锰酸钾溶液和溴水褪色的原理相同
C. 物质c与物质d互为同分异构体
D. 物质d的一氯代物有2种
难度: 困难查看答案及解析
-
甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A
CH2=C(CH3)COOCH3,下列说法正确的是
A. 已知该反应的原子利用率为100%,则A为CO2
B. CH3OH和甘油互为同系物
C. CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D. 能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
难度: 困难查看答案及解析
-
一种新型的“锂-呼吸CO2电化学装置”的结构如下图所示,下列说法正确的是

A. 该装置可由电能转变为化学能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:C2O42--2e-=2CO2
D. 每生成10.2gLi2C2O4,有0.2molLi+从正极迁移至负极
难度: 困难查看答案及解析
-
25℃时,用0.1000 mol·L−1的AgNO3溶液分别滴定体积均为V0mL的且浓度均为0.1000mol·L−1的KCl、KBr及KI溶液,其滴定曲线入下图,已知25℃时,AgCl、AgBr及AgI溶度积常数依次为l.8×10-10、5.0×10-13、8.3×10-17,下列说法正确的是
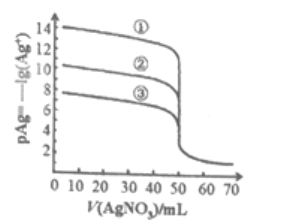
A. V0= 45.00
B. 滴定曲线①表示KCl的滴定曲线
C. 滴定KCl时,可加入少量的KI作指示剂
D. 当AgNO3溶液滴定至60.00mL时,溶液中c(I)<c(Br)<c(Cl)
难度: 困难查看答案及解析
-
常温下,向20 mL 0.1mol/L的K2CO3溶液中逐滴加入0.1mol/L的稀盐酸40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是
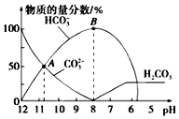
A. 随着稀盐酸的加入,溶液中c(HCO3-)·c(OH-)/c(CO32-)保持不变
B. 根据A点计算,Ka2(H2CO3)的数量级为10-3
C. B点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. 当pH约为8时,溶液中开始放出CO2气体
难度: 中等查看答案及解析
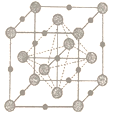 (小球为V原子)
(小球为V原子)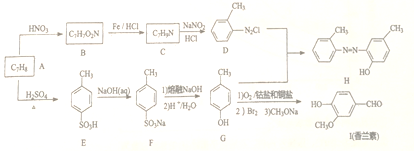
 的合成路线___________。
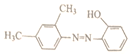
的合成路线___________。