-
我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指
A. 氨水 B. 硝酸 C. 醋 D. 卤水
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 过氧化钠的电子式:
B. 质子数为35、中子数为45的溴原子:
C. 硫离子的结构示意图:
D. H2O2的电子式:
难度: 简单查看答案及解析
-
下列关于物质的分类中,正确的是
酸性氧化物
酸
盐
混合物
电解质
A
SiO2
HClO
烧碱
KAl(SO4)2·12H2O
C2H5OH
B
Na2O2
HNO3
NaHSO4
漂白粉
Mg
C
SO3
H2SiO3
纯碱
水泥
NaCl
D
NO
Al(OH)3
BaCO3
铝热剂
NH3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是

A. 浓H2SO4 B. NaOH溶液 C. 浓盐酸 D. 饱和NaCl溶液
难度: 简单查看答案及解析
-
将足量X气体通入Y溶液中,实验结果与预测的现象一致的组合是
X气体
Y溶液
预测的现象
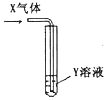
①
CO2
饱和Na2CO3溶液
白色沉淀析出
②
SO2
Ba(NO3)2溶液
白色沉淀析出
③
Cl2
AgNO3溶液
白色沉淀析出
④
NH3
AlCl3溶液
白色沉淀析出
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. ①②③④
难度: 简单查看答案及解析
-
下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、陶瓷都是硅酸盐产品
③高纯度的硅单质广泛用于制作光导纤维
④普通玻璃是氧化物,成分可表示为SiO2
⑤粗硅制备单晶硅不涉及氧化还原反应
A. ①② B. ①②③ C. ①②③④ D. ②③④⑤
难度: 简单查看答案及解析
-
将含有等体积NH3、CO2、NO的混合气体依次通过盛有H2SO4、Na2O2和Na2CO3溶液的装置,充分作用后,最后得到的气体是
A. CO2,NO B. NO,NH3 C. CO,O2 D. NO2,CO2
难度: 简单查看答案及解析
-
A、B是短周期元素,最外层电子排布式分别为3s2,2s22p3。A与B形成的离子化合物加蒸馏水溶解后可使酚酞试液变红,同时有气体逸出,该气体可使湿润的红色石蕊试纸变蓝,则该化合物的分子量是
A. 38 B. 55 C. 100 D. 135
难度: 简单查看答案及解析
-
下列各组离子中,在溶液中能大量共存的是( )
A. H+,OH-,Na+,SO42- B. Fe3+,Cl-,K+,I-
C. Cu2+,NO3-,Na+,Cl- D. Ba2+,Cl-,K+,CO32-
难度: 简单查看答案及解析
-
下图所示的实验装置图正确且能达到相应实验目的的是
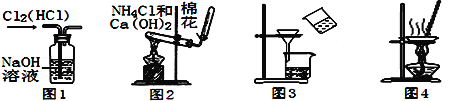
A. 用图1所示装置除去Cl2中的HCl
B. 用图2所示装置实验室制NH3
C. 用图3所示装置分离MnO2和KCl
D. 用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A. Na2O2溶于水:Na2O2+H2O=2Na++2OH-+O2↑
B. 向氧化铁中加入氢碘酸发生反应:Fe2O3+6HI=2Fe2++I2+3H2O+4I-
C. 氯化铝溶液中加入过量氨水:Al3++4NH3﹒H2O=AlO2-+4NH4++2H2O
D. 漂白粉溶液中通入过量的CO2:ClO-+CO2+H2O=HClO+HCO3-
难度: 中等查看答案及解析
-
下列各组物质中,满足表中图示物质在通常条件下能一步转化的全部组合是
序号
X
Y
Z
W
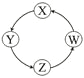
①
Cu
CuSO4
Cu(OH)2
CuO
②
Na
NaOH
Na2CO3
NaCl
③
Cl2
Ca(ClO)2
HClO
HCl
④
Fe
FeCl3
FeCl2
Fe(OH)2
A. ①②③ B. ①③④ C. ②③ D. ①④
难度: 中等查看答案及解析
-
下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al
Al2O3+2Fe;1∶2
③SiO2+3C
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
难度: 简单查看答案及解析
-
FeSO4可发生如图所示的一系列反应,下列说法错误的是
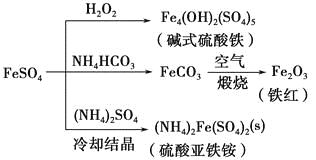
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
难度: 中等查看答案及解析
-
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
A. 滴加KI溶液时,KI被氧化,CuI是还原产物
B. 通入SO2后,溶液变无色,体现SO2的还原性
C. 整个过程发生了复分解反应和氧化还原反应
D. 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
难度: 中等查看答案及解析
-
已知短周期元素离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是()
A. 离子半径 C>D>B>A
B. 原子序数 d>c>b>a
C. 原子半径 A>B>D>C
D. 单质的还原性 A>B>D>C
难度: 中等查看答案及解析
-
在一定温度下,某浓度的硝酸与金属锌反应,生成NO2和NO的物质的量之比为1︰3。则要使1mol金属锌完全反应,需要HNO3的物质的量为
A. 0.8 B. 2.4 C. 2.6 D. 2.8
难度: 简单查看答案及解析
-
在某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入1.92g铜粉微热,待充分反应后,溶液中Cu2+物质的量浓度约为
A. 0.15mol/L B. 0.3mol/L C. 0.225mol/L D. 无法计算
难度: 中等查看答案及解析
-
aL CO2气体通过足量Na2O2所得的气体与bL NO相混和时,可得到cL气体(相同状况),以下表达式中错误的是
A. 若a<b,则c>0.5(a+b) B. 若a>b,则c=0.5(a+b)
C. 若a=b,则c=0.5(a+b) D. 若a<b,则c<0.5(a+b)
难度: 困难查看答案及解析
-
3.84g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到1344mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积
A. 672mL B. 168mL C. 504mL D. 336mL
难度: 简单查看答案及解析
