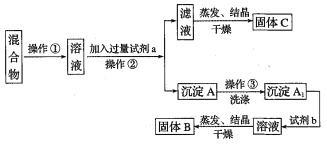
-
在下列条件下,两种气体的分子数一定相等的是
A. 同密度、同压强的氮气和乙烯
B. 同温度、同体积的氧气和氮气
C. 同体积、同密度的乙烯和一氧化碳
D. 同压强、同体积的氧气和氮气
难度: 简单查看答案及解析
-
下列实验操作中错误的是( )
A. 蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发。
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 中等查看答案及解析
-
欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4 溶于100ml水中
②将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A. ①② B. ②③ C. ①③ D. ①②③
难度: 简单查看答案及解析
-
检验某未知溶液中是否含有SO42-,下列操作最合理的是 ( )
A. 加入稀硝酸酸化的Ba(NO3)2溶液
B. 加入盐酸酸化的BaCl2溶液
C. 先加稀硝酸酸化,再加Ba(NO3)2溶液
D. 先加盐酸酸化,再加BaCl2溶液
难度: 中等查看答案及解析
-
某固体A在一定条件下可完全分解,生成B、C、D三种气体的混合物。反应方程式如下:2A=B↑+2C↑+3D↑,此时测得混合气体的相对平均分子质量为30,则固体A的摩尔质量为( )
A. 30g/mol B. 90g/mol C. 30 D. 90
难度: 简单查看答案及解析
-
草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中.下列有关判断不正确的是( )
A. 45g草酸中含有1.204×1024个氧原子
B. 1mol草酸中含有6.02×1023个分子
C. 草酸的摩尔质量是90g·mol-1
D. 1mol草酸在标准状况下的体积约为22.4L
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 1mol H2O的质量为18g
B. 摩尔是表示物质微粒数目的一个物理量
C. 3.01×1023个SO2分子的质量为64g
D. 标准状况下,1mol任何物质体积均约为22.4L
难度: 中等查看答案及解析
-
溶液和胶体的本质区别在于( )
A. 分散质微粒直径大小不同 B. 是否均一、稳定
C. 是否能发生丁达尔效应 D. 是否透明
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 1mol/L Na2SO4溶液含有2NA个Na+
B. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
C. 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA
D. 18g NH4+所含电子数为11NA
难度: 简单查看答案及解析
-
下列溶液中c(Cl-)与50mL 1 mol/L的AlCl3溶液中的c(Cl-)相等的是
A. 150mL 1mol/L NaCl B. 75mL 2mol/L CaCl2
C. 150mL 3mol/L KClO3 D. 75mL 1mol/L FeCl3
难度: 简单查看答案及解析
-
以下实验装置一般不用于分离物质的是
A.
B.
 C.
C.  D.
D. 难度: 简单查看答案及解析
-
下列现象与胶体的性质无关的是( )
A. 夏日的傍晚常常看到万丈霞光穿云而过美不胜收
B. 过滤除去氯化钠溶液中的泥沙
C. 食品加工厂利用豆浆中加入盐卤做豆腐
D. 化工厂利用静电除尘技术去除废气中的固体悬浮物
难度: 中等查看答案及解析
-
把500mL含BaCl2和KCl的混合溶液分成两等份,向其中一份中加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;向另一份中加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A. 0.25(b-2a)mol/L B. 4(2a-b)mol/L C. 2(b-2a)mol/L D. 4(b-2a)mol/L
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
①标准状况下,1L HCl和1LH2O的物质的量相同;
②标准状况下,11.2L H2和14g N2所含原子数相同;
③28g CO的体积约为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ⑤⑥ B. ②⑤⑥ C. ②③⑤⑥ D. ①②④⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是
A. 0.5molNaCl溶解在1L水中得到0.5mol/LNaCl溶液
B. 标准状况下,22.4L HCl气体溶于水得到1L溶液,最终盐酸浓度为1mol/L
C. 将40g NaOH完全溶解于1L水中,所得溶液的物质的量浓度为1mol/L
D. 从100mL 1mol/LNaCl溶液中取出10mL,所得溶液的物质的量浓度为0.1mol/L
难度: 中等查看答案及解析
-
标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g·mL-1,质量分数为ω,物质浓度为c mol·L−1,则下列关系中正确的是( )
A. c=
B. ω=
C. ω=
D. ρ=
难度: 困难查看答案及解析
-
下列操作中正确的是( )
A. 用两个250mL的容量瓶配制0.1mol/L 500mL的NaOH溶液
B. 在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中称量
C. 用25mL量筒量取4.0mol/L的盐酸5.62mL
D. 用托盘天平准确称取5.85g NaCl固体
难度: 简单查看答案及解析
-
200 mL 0.3 mol/L的K2SO4溶液和100 mL 0.2 mol/L的Fe2(SO4)3溶液混合后(不考虑混合后溶液体积的变化),溶液中SO42-的物质的量浓度为
A. 0.3 mol/L B. 0.4 mol/L C. 0.45 mol/L D. 0.5 mol/L
难度: 中等查看答案及解析