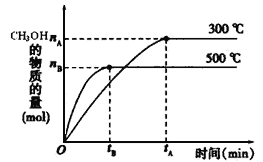
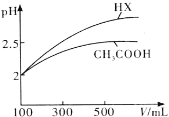
-
下列关于电离常数(K)的说法正确的是
A. 电离平衡常数只与温度有关,升高温度,K值减小
B. 电离常数K与温度无关
C. 电离常数(K)越小,表示弱电解质的电力能力越弱
D. 多元弱酸各步电离常数相互关系为K1<K2<K3
难度: 简单查看答案及解析
-
在醋酸溶液中,CH3COOH电离达到平衡的标志是
A. 溶液显酸性
B. 溶液中无CH3COOH分子存在
C. 氢离子浓度恒定不变
D. c(H+)= c(CH3COO-)
难度: 中等查看答案及解析
-
下列说法正确的是
A. 水是弱电解质
B. NaHCO3的电离方程式为NaHCO3===Na++H++CO32-
C. KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
D. BaSO4的水溶液不易导电,故BaSO4是弱电解质
难度: 中等查看答案及解析
-
对于反应2A(g)+B(g)
2C(g)(正反应放热),下列图象正确的是
A.
 B.
B.  C.
C.  D.
D. 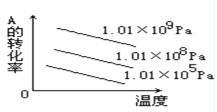
难度: 简单查看答案及解析
-
下表中物质的分类组合完全正确的是
选项
A
B
C
D
强电解质
KNO3
H2SO4
BaSO4
HClO4
弱电解质
HF
CaCO3
HClO
CH3COONH4
非电解质
SO2
Al
H2O
C2H5OH
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
醋酸的电离方程式为CH3COOH(aq)
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
难度: 简单查看答案及解析
-
已知水的电离方程式:H2O
H+ + OH-,下列叙述中正确的是
A. 升高温度,KW增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,KW不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
难度: 简单查看答案及解析