-
下列说法中正确的有几个
①2018年春节联欢晚会上,港珠澳大桥出现了百部无人驾驶汽车。大力推广无人驾驶汽车有助于缓解能源危机和节约资源②KMnO4、C2H5OH、H2O2等常见化学物质都可作医用杀菌、消毒剂③用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,但与氯气不同的是不产生有机氯对人体造成危害④面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,也属于离子化合物,其阴阳离子个数比为1∶1⑤国产大飞机-----C919使用的碳纤维是一种新型的无机非金属材料⑥“浮梁巧烧瓷,颜色比琼玖”,描述的是我国驰名于世的陶瓷,陶瓷是一种硅酸盐产品⑦“青蒿一握,以水二升渍,绞取汁”,该过程属于物理变化⑧使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
A. 5个 B. 6个 C. 7个 D. 8个
难度: 中等查看答案及解析
-
下列说法不正确的有几个
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③Cl2中35C1与37Cl两种核素的个数之比与HCl中35Cl与37C1的个数之比相等
④18 g H2O中含有的中子数为10NA
⑤标准状况下,等体积CH4和HF所含的分子数相同
⑥只有活泼金属元素与活泼非金属元素之间才能形成离子键
⑦等物质的量的CN-和N2含有的共用电子对数相等
⑧通过化学变化可以实现16O与18O之间的相互转化
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
某有机物的结构如图所示。有关该物质的下列说法正确的是( )
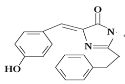
A. 该物质能发生加成反应、取代反应
B. 不能与Br2的CCl4溶液发生反应
C. 该物质中所有原子有可能在同一平面
D. 该化合物的分子式为C18H17O2N2
难度: 中等查看答案及解析
-
除去下列物质中的杂质选用的试剂和方法最合理的是
物质
杂质
试剂
方法
A
甲烷
乙烯
酸性高锰酸钾溶液
洗气
B
氯化亚铁溶液
氯化铁
过量铁粉
过滤
C
二氧化硅
氧化铝
氢氧化钠溶液
过滤
D
乙酸乙酯
乙酸
饱和碳酸钠溶液
蒸馏
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 加水稀释0.01 mol·L-1的CH3COOH溶液,溶液中c(OH-)减小
B. 室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 氨水加水稀释后,溶液中c(NH3·H2O)/c(NH4+)的值增大
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
难度: 中等查看答案及解析
-
2017年8月3日,中国科学家在《Nature》杂志发表论文,合成了一种代号为ICM-101的高能量密度材料。合成该高能物质的主要原料为草酰二肼,结构简式如图所示。下列有关草酰二肼的说法正确的是
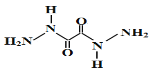
A. 可由草酸(HOOC-COOH)和肼(H2N-NH2)发生酯化反应制备
B. 不能发生水解反应
C. 与联二脲(H2NCONHNHCONH2)互为同分异构体
D. 分子中最多有12个原子处于同一平面
难度: 中等查看答案及解析
-
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是
A. 向溴水中加入足量氯化亚铁溶液能使溴水褪色
B. 能使pH试纸显蓝色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存
C. 向NaClO溶液中通入少量二氧化碳的离子方程式2ClO-+CO2+H2O═2HClO+CO32-
D. 向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-
难度: 中等查看答案及解析
-
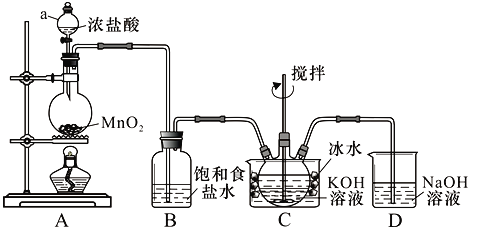
(题文)下列有关实验装置,能达到实验目的的是
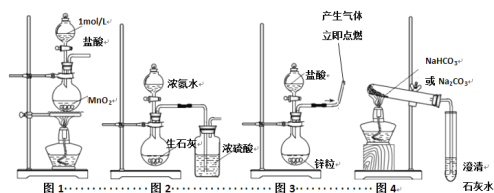
A. 用图1所示装置制取少量Cl2 B. 用图2所示装置制取干燥的NH3
C. 用图3制备并检验H2的可燃性 D. 用图4装置鉴别碳酸钠和碳酸氢钠
难度: 简单查看答案及解析
-
向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
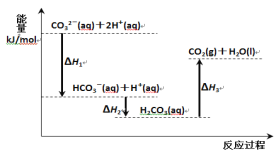
A. 反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应
B. CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) ∆H=(∆H1+∆H2+∆H3)
C. ∆H1>∆H2 ∆H2<∆H3
D. H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则∆H3变小
难度: 简单查看答案及解析
-
A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法正确的是
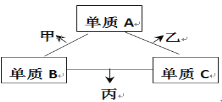
A. 甲、乙、丙三种物质的水溶液均显碱性
B. 甲是碱性氧化物,乙是酸性氧化物
C. 甲、乙可能都有漂白性,其漂白原理相同
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
难度: 中等查看答案及解析
-
一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
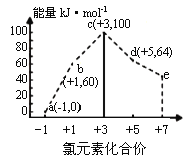
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO(aq)=ClO3-(aq)+2Cl-(aq);ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
难度: 中等查看答案及解析
-
常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是
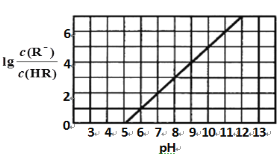
A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
难度: 困难查看答案及解析
-
对下列两种有机物的描述正确的是
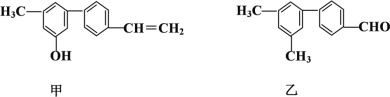
A. 苯环上的一氯代物种数相同
B. 分子中共面的碳原子数一定相同
C. 1 mol甲与浓溴水反应最多能消耗4 mol Br2
D. 甲、乙可用红外光谱区分,但不能用核磁共振氢谱区分
难度: 中等查看答案及解析
-
下列说法正确的是
A. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
B. 可采取加热蒸发的方法使FeCl3从水溶液中结晶析出
C. NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D. 将SO2分别通入硝酸钡溶液和溶有氨气的氯化钡溶液中,产生沉淀的成分相同
难度: 中等查看答案及解析
-
常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A. b点溶液中离子浓度由大到小的顺序为: c(Na+)>c(SO42—)>c(NH4+)>c(H+)>c(OH-)
B. 图中b、c、d 三点溶液中水的电离程度最大的是c点
C. b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D. pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42—)+c(OH-)
难度: 简单查看答案及解析
-
下列各组物质的分类正确的是
①混合物:氯水、氨水、水玻璃、水银、福尔马林、淀粉
②含有氧元素的化合物叫氧化物
③CO2、NO2、P2O5均为酸性氧化物,Al2O3、CaO2为碱性氧化物
④同素异形体:C60、C70、金刚石、石墨
⑤强电解质溶液的导电能力一定强
⑥在熔化状态下能导电的化合物为离子化合物
⑦有单质参加的反应或有单质生成的反应是氧化还原反应
A. 全部正确 B. ① ② ⑤ ⑦ C. ② ③ ⑥ D. ④ ⑥
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得结论正确的是
选项
实验操作和现象
结论
A
用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色
溶液中含有Na+
B
向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。
Ksp[Fe(OH)3]<Ksp[Al(OH)3]
C
室温下,用pH试纸测得:0.1 mol·L-1 Na2CO3溶液的pH约为11;0.1 mol·L-1 NaHCO3溶液的pH约为8。
HCO3-结合H+的能力比CO32-的强
D
用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净
存在可逆过程:
Fe3++Ag
Fe2++Ag+,且溶解度AgCl<Ag2SO4
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
新型纳米材料氧缺位铁酸盐(MFe2Ox),能使SO2、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述不正确的是
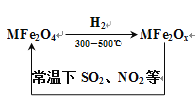
A. MFe2O4表现了氧化性
B. 若MFe2Ox与SO2发生反应的物质的量之比为3:1,则x=10/3
C. 在处理该废气过程中,每处理含1moINO2的废气转移电子数4NA个
D. MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应
难度: 困难查看答案及解析
-
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、[Al(OH)4]-中的若干种离子,离子浓度均为0.1mol·L-1,某同学进行了如下实验,下列说法正确的是
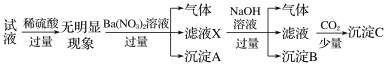
A. 无法确定原试液中是否含有Al3+、Cl-
B. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
C. 无法确定沉淀C的成分
D. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
难度: 困难查看答案及解析
-
某芳香族酯类化合物甲的分子式为C14H10O5,1 mol甲水解后只生成一种产物乙,其物质的量为2 mol,下列说法不正确的是
A. 符合上述条件的甲共有3种 B. 乙能和浓溴水发生反应
C. l mol乙最多消耗2 mol NaHCO3 D. 1 mol 甲最多可以和4 mol NaOH反应
难度: 中等查看答案及解析
-
化学与生活密切相关,以下所有描述中正确的有几个
① 分子筛、青花瓷、黏土、玛瑙、硅石的主要成分都是硅酸盐。
② 含4%硅的硅钢导磁性很强,主要用作变压器的铁芯。
③ 氟碳化合物不仅可用于制家用不粘锅的保护膜氟纶,还可能成为未来的人造血液。
④ 由于r(F-)比r(OH-)小,在磷灰石晶体结构里更匹配,使得氟磷灰石更能抵抗酸的侵蚀,因此含氟牙膏可有效预防龋齿。
⑤ 石膏与水的糊状混合物会很快凝固,可用它做模型和石膏绷带。
⑥ 煤焦油干馏可获得苯、二甲苯等有机物。
⑦ 二氧化硫有毒,严禁将其添加到任何食品和饮料中。
⑧ 臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水消毒剂。
⑨ 奶油、代可可脂巧克力、乳饮料、奶茶、蛋黄派等零食都可能含反式脂肪酸。
A. 3个 B. 4 个 C. 5个 D. 6个
难度: 困难查看答案及解析
-
NA表示阿伏加德罗常数的数值,下列说法正确的是
① 3.9g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA
② 3.1g氧化钠和3.9g过氧化钠的混合物中含有的阴离子总数为0.1NA
③ 1.8g14CH4和水蒸气(H2O)的混合气体中含电子数目为NA
④ 常温下1L 0.5 mol/L NH4Cl溶液与2L 0.25 mol/L NH4Cl溶液所含NH4+的数目相同
⑤ 常温下,4.6gNO2和N2O4组成的混合气体中所含原子总数为0.3NA
⑥ 1mol SiO2晶体中含有极性共价键数目为2NA
⑦ 将1mol Cl2通入足量水中, 溶液中HClO、Cl-、C1O-粒子数之和为2NA
⑧ 高温下,16.8g Fe与足量水蒸气完全反应转移电子数为0.8NA
A. ① ② ④ ⑥ B. ② ③ ⑤ ⑧ C. ② ③ ⑥ ⑦ D. ③ ⑤ ⑦ ⑧
难度: 中等查看答案及解析
-
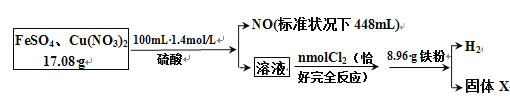
球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:
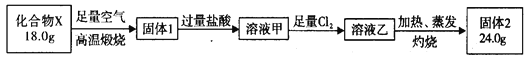
下列说法不正确的是
A. 固体2是氧化铁
B. X的化学式可以表示为Fe3C2
C. 溶液甲加热、蒸发、灼烧也可得到24.0 g固体
D. X与足量的热浓硝酸反应有NO2和CO2生成
难度: 困难查看答案及解析
-
工业上用Fe2(SO4)3酸性溶液处理SO2废气的工艺流程如下,下列说法不正确的是
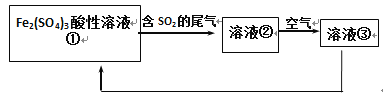
A. 溶液的pH:①>②>③
B. 整个过程中Fe2(SO4)3溶液可以循环利用
C. 溶液②转化为溶液③发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O
D. 向②溶液中滴加KSCN溶液,溶液可能变为血红色
难度: 困难查看答案及解析
-
下列有关实验现象、解释和结论都正确的是
选项
实验操作
实验现象
解释或结论
A
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变深
反应2NO2
N2O4的△H<0
B
淀粉水解后的溶液加入新制Cu(OH)2浊液,再加热
无砖红色沉淀
淀粉水解产物不含醛基
C
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
D
向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 mol/L的NaI溶液,再振荡,
先生成白色沉淀,后产生黄色沉淀
Ksp(AgI)<Ksp(AgCl)
A. A B. B C. C D. D
难度: 中等查看答案及解析
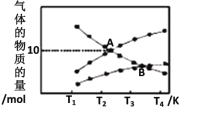
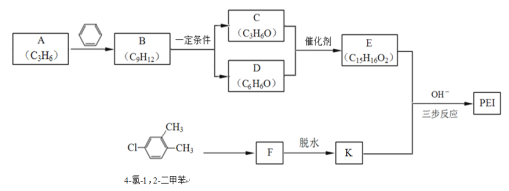
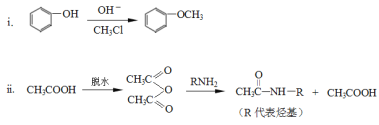
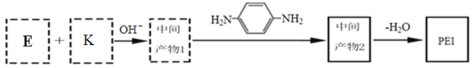
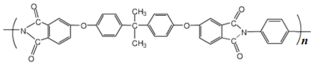 ]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):
]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):