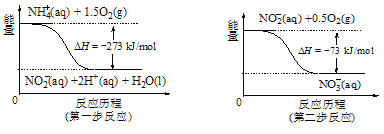-
(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1mol•L-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
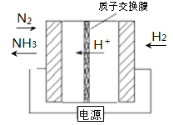
(3)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。
(4)废水中含氮化合物的处理方法有多种。
① NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液______________L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是______________kJ。
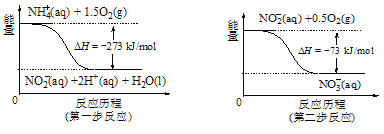
③ 用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH______(填“升高”、“降低”或“不变”)。
(5)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=_______。 [常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
-
现有常温下的四种溶液:
| 溶液编号 | ① | ② | ③ | ④ |
| 溶液名称 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| 离子浓度 | pH=11 | c(OH-)=10-3mol/L | c(CH3COO-)=10-3mol/L | c(Cl-)=10-3mol/L |
下列有关叙述正确的是( )
A.分别加水稀释10倍后四种溶液的pH大小顺序为②>①>④>③
B.将①、④两种溶液等体积混合所得溶液中
C.在③、④中分别加入少量醋酸铵晶体至常温后溶液的pH均增大.Kw均不变
D.等体积的四种溶液分别发生中和反应时所需另一种溶液溶质的物质的量相等
-
25℃,加水稀释10mLpH=11的氨水,下列判断正确的是
A.原氨水的浓度=10-3mol /L
B.氨水的电离程度增大,溶液中所有离子的浓度均减小
C.溶液中 的增大
的增大
D.再加入10mLpH=3的盐酸,混合液pH=7
-
下列关于常温下电解质溶液的叙述中,正确的是( )
A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O
B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-)
C.等物质的量浓度的NH4Cl溶液和NH3•H2O溶液,溶液中c(NH4+)前者小于后者
D.25℃时,pH=8的0.1mol•L-1 NaX溶液中由水电离出的c (OH-)=1×10-8mol•L-1
-
下列关于常温下电解质溶液的叙述中,正确的是( )
A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O
B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-)
C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者
D.25℃时,pH=8的0.1 mol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8 mol·L-1
-
下列关于常温下电解质溶液的叙述中,正确的是
A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O
B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+ c(NH4+)= c(Cl-)+ c(OH-)
C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者
D.25℃时,pH=8的0.1mol·L-1NaX溶液中由水电离出的c (OH-)=1×10-8mol·L-1
-
常温下,下列溶液中的微粒浓度关系正确的是
A.氯气通入氢氧化钠溶液中:
B.pH=8.3的NaHCO3溶液:
C.pH=11的氨水与pH=3的盐酸等体积混合:
D.某溶液中只存在 四种离子,则可能存在:
四种离子,则可能存在:
-
(10分)常温下,在20g盐酸和硫酸混合液中,逐滴加入17.1%的氢氧化钡溶液。当碱液滴加至20g时,硫酸钡沉淀达到量大值;当碱液滴加至60g时,溶液pH等于7。求:
(1)起始混合液中硫酸的质量分数。
(2)起始混合液中HCl的质量分数。
(3)25℃时,当溶液pH=7时, 蒸发掉溶液中的水43.02g,冷却至原温度后,过滤烘干得4.98g固体。求此时氯化钡的溶解度。
-
下列说法正确的是( )
A.将100g 10%的盐酸加热蒸发,得到50克溶液,其浓度为20%
B.把3mol/L的硫酸跟等体积的水混合,所得溶液的浓度大于1.5mol/L
C.把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L
D.已知某温度KNO3的溶解度是31.6g/100g水,在该温度下将20g KNO3溶解于50g 水中,所得溶液的质量分数是28.6%
-
常温下,pH>7的某溶液中只含有Na+、CH3COO-、H+、OH-四种离子,下列描述正确的是
A.该溶液只能由等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液混合而成
B.该溶液一定由pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合而成
C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.加入一定冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+)