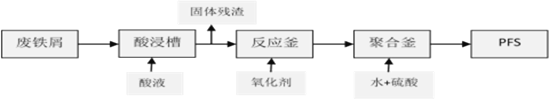
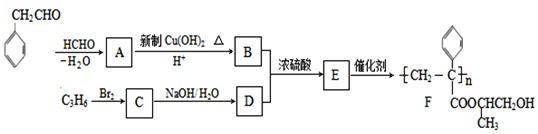
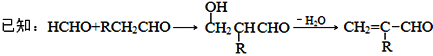
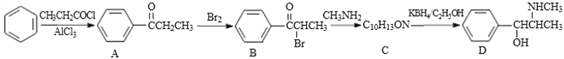
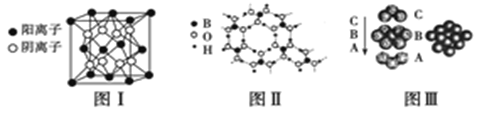
-
下列利用相关数据作出的推理或判断一定正确的是
A. 利用焓变数据判断反应能否自发进行 B. 利用溶液的pH判断该溶液的酸碱性
C. 利用平衡常数判断反应进行的程度大小 D. 利用反应热数据判断反应速率的大小
难度: 中等查看答案及解析
-
材料与人类生活密切相关,下列物品中最难降解的是
A. 真丝围巾 B. 宣纸 C. PVC塑料卡片 D. 淀粉做的餐具
难度: 简单查看答案及解析
-
下列各项叙述中,正确的是( )
A. 能层序数越大,s原子轨道的形状不相同,但半径越大
B. 在同一电子层上运动的电子,其自旋方向肯定不同
C. 镁原子由1s22s22p63s2→ls22s22p63p2时,原子吸收能量,由基态转化成激发态
D. 原子价电子排布式为5s1的元素,其氢氧化物不能使氢氧化铝溶解
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 晶格能由大到小:MgO>CaO>NaF> NaCl
B. 某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时生成的阳离子是X2+
C. 熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、离子晶体
D. 含极性键的非极性分子往往是高度对称的分子,比如CO2、BF3、CH4这样的分子
难度: 简单查看答案及解析
-
下图所示的装置中,与手机充电的能量转化形式相同的是( )
A.
 电解水 B.
电解水 B. 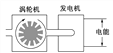 水力发电 C.
水力发电 C.  太阳能热水器 D.
太阳能热水器 D.  干电池
干电池难度: 中等查看答案及解析
-
25℃时,下列关于0.1 mol·L-1的氨水和0.1 mol·L-1的醋酸溶液说法正确的是( )
A. 0.1 mol·L-1的氨水溶液,pH=13
B. 0.1 mol·L-1的醋酸加水稀释,溶液中c(H+)和c(OH-)都减小
C. 0.1 mol·L-1的醋酸溶液中:c(OH-)+c(CH3COO-)=c(H+)
D. 0.1 mol·L-1的氨水与0.1 mol·L-1盐酸溶液等体积混合所得溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,错误的是:

A. 装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B. 装置②可用于收集H2、NH3、Cl2、HCl、NO2
C. 装置③检查乙炔的还原性(实验室是由饱和食盐水与电石制乙炔,产生的混合气体除乙炔外,常含有H3P ,H2S等杂质气体)
D. 装置④可用于干燥、收集氨气、并吸收多余的氨气
难度: 中等查看答案及解析
-
(2013•吉林模拟)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A. 增加压强 B. 降低温度 C. 增大CO的浓度 D. 更换催化剂
难度: 中等查看答案及解析
-
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
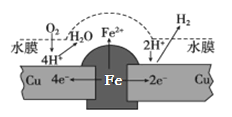
A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流电源负极相连,则铁铜均难被腐蚀
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
B. 滴入酚酞试液显红色的溶液中:K+、Fe3+、ClO-、SO42-
C. c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+
D. 由水电离出的c(H+)=1×10-12mol/L的溶液中:Na+、K+、Cl-、HCO3-
难度: 中等查看答案及解析
-
25°C时,水的电离达到平衡:H2O
H++OH-,下列叙述正确的是
A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变
D.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱
难度: 简单查看答案及解析
-
肉桂酸异戊酯是一种香料,其结构简式如图。下列有关肉桂酸异戊酯的叙述正确的是( )
A.不能使酸性KMnO4溶液褪色
B.能与新制的碱性Cu(OH)2悬浊液共热生成红色沉淀
C.能与FeCl3溶液反应显紫色
D.能与热的浓硝酸和浓硫酸混合液反应
难度: 中等查看答案及解析
-
下列物质中,不能使酸性KMnO4溶液褪色的是( )
①
②CH3CH2OH ③
 ④CH3COOH ⑤CH2=CH-COOH ⑥
④CH3COOH ⑤CH2=CH-COOH ⑥A. ①③⑤ B. ①④⑥ C. ②⑤⑥ D. ①③④
难度: 简单查看答案及解析
-
下列关于有机物的叙述正确的是( )
A. 乙烯和苯都能使溴水褪色,褪色的原因相同
B. 分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸
C. 油脂和纤维素都是能发生水解反应的高分子化合物
D. 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应
难度: 中等查看答案及解析
-
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某兴奋剂的结构简式如下图所示。下列有关说法正确的是 ( )
A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 滴入酸性KMnO4溶液,紫色褪去,即证明其结构中肯定存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为2 mol和7 mol
D. 该分子中的所有碳原子可以共平面
难度: 中等查看答案及解析
-
下列关于有机物结构、性质的说法正确的是( )
A. 石油的分馏、裂化和煤的干馏都是化学变化
B. 乙烯分子与苯分子都能与H2发生加成反应,说明二者所含碳碳键相同
C. 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应
D. 淀粉、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物
难度: 简单查看答案及解析
-
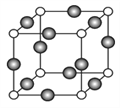
三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体是( )
A. 金属晶体 B. 离子晶体 C. 分子晶体 D. 原子晶体
难度: 简单查看答案及解析
-
对价电子构型为2s22p5的元素描述正确的是( )
A. 原子半径最小 B. 原子序数为7 C. 第一电离能最大 D. 电负性最大
难度: 简单查看答案及解析
-
下列说法错误的是( )
A. 在NH4+和[Cu(NH3)4]2+中都存在配位键
B.
σ键和π键比例为7:1
C. C22-与O22+互为等电子体,1 mol O22+中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
难度: 困难查看答案及解析
-
下列关于氨气和甲烷的说法不正确的是( )
A. 两种分子的VSEPR模型相同
B. NH3分子中N原子形成四个不等性杂化轨道,CH4分子中C原子形成4个等性杂化轨道
C. NH3分子中有一对未成键的孤对电子,而甲烷分子中没有孤对电子,两分子的立体构型不同
D. 氨气分子和甲烷分子都是含有极性键的非极性分子
难度: 中等查看答案及解析