-
下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4 稀释
④固体NaOH溶于水 ⑤ H2 在 Cl2 中燃烧 ⑥食物腐败
A. ②⑤⑥ B. ②③④ C. ①③⑤ D. ②③④⑤⑥
难度: 中等查看答案及解析
-
未来新能源的特点是资源丰富,使用时对环境无污染或很少污染,且有些可以再生,下列全部属于新能源的是一组是( )
①天然气 ②煤 ③核能 ④石油 ⑤海洋能 ⑥地热能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
难度: 简单查看答案及解析
-
下图为H2与O2反应生成H2O(g)的能量变化示意图,下列有关叙述不正确的是
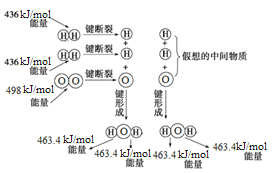
A. 1 mol H2分子断键需要吸收436 kJ的能量
B. H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
C. 反应物的总能量高于生成物的总能量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量小
难度: 简单查看答案及解析
-
某温度下,在一恒容容器中进行如下反应N2+3H2
2NH3,下列情况一定能说明反应 已达到平衡的是( )
①容器内压强不随时间而变化
②单位时间内,有3molH2反应,同时有2molNH3生成
③气体的密度不随时间而变化
④单位时间内,有1molN2生成,同时有2molNH3生成
⑤用N2、H2、NH3表示的该反应的化学反应速率之比为1∶3∶2
⑥气体的平均摩尔质量不随时间而变化
A. ①④⑥ B. ①②③ C. ②③⑤ D. ①②⑥
难度: 困难查看答案及解析
-
下列有关热化学方程式及其叙述正确的是( )
A. H2的燃烧热为285.8 kJ/mol,则H2O分解的热化学方程式为:2H2O(l) = 2H2(g)+O2(g) ΔH=+285.8 kJ/mol
B. 1 mol CH4完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为:1/2CH4(g)+O2(g) = 1/2CO2(g)+H2O(l) ΔH=-445 kJ/mol
C. 已知2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ/mol,则C的燃烧热为110.5 kJ/mol
D. HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ/mol
难度: 中等查看答案及解析
-
已知:
①H2(g)+
O2(g)
H2O(g);ΔH1= a kJ·mol-1
②2H2(g)+O2(g)
2H2O(g);ΔH2= b kJ·mol-1
③H2(g)+
O2(g)
H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g)
2H2O(l);ΔH4= d kJ·mol-1
下列关系正确的是( )
A. c<a <0 B. b>a > 0 C. 2a=d <0 D. 2c=d >0
难度: 中等查看答案及解析
-
对于反应4NH3+5O2=4NO+6H2O,下列为4种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A. v(NH3)=0.2 mol·L-1·s-1
B. v(O2)= 14 mol·L-1·min-1
C. v(H2O)=0.25 mol·L-1·s-1
D. v(NO)=9 mol·L-1·min-1
难度: 简单查看答案及解析
-
(题文)反应2NO2(g)
N2O4(g) ΔH<0;在温度为T1、T2时,平衡体系中NO2的体积分数随体系压强变化曲线如图所示。下列说法错误的是( )
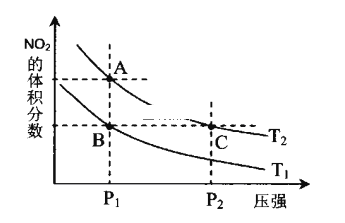
A. T2 > T1,P2 > P1 B. B、C两点的反应速率:B > C
C. A点的气体颜色比B点的深 D. A、C两点气体的平均相对分子质量:A < C
难度: 简单查看答案及解析