-
下列化工生产过程中,未涉及氧化还原反应的是( )
A. 海带提碘 B. 氯碱工业
C. 氨碱法制碱 D. 海水提溴
难度: 中等查看答案及解析
-
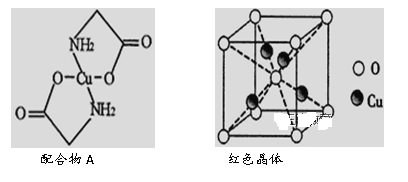
硅酸铜钡是利用最新科学技术才合成的一种物质,然而科学家惊奇发现,我国秦朝兵马俑的一种颜料竟是硅酸铜钡.由以上事实推测关于硅酸铜钡的说法不正确的是
A. 难氧化 B. 难溶于水 C. 属于硅酸盐 D. 属于混合物
难度: 中等查看答案及解析
-
欲除去下列各物质中的少量杂质,括号内试剂选择正确的是
A. 溴苯中的溴(KI溶液) B. 溴乙烷中的乙醇(NaOH溶液)
C. 苯中的甲苯(溴水) D. 乙酸乙酯中的乙酸(饱和Na2CO3溶液)
难度: 中等查看答案及解析
-
化学无处不在,与化学有关的说法不正确的是
A. 绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的物质
B. 回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源
C. 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D. 根据硅原子核外电子排布可知,硅元素的化学性质稳定,自然界中存在大量硅单质
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A. SO2具有氧化性,可用于漂白纸浆 B. NaHCO3能与碱反应,可用作焙制糕点的膨松剂
C. Fe2(SO4)3易溶于水,可用作净水剂 D. 液氨汽化时吸收大量的热,可用作制冷剂
难度: 中等查看答案及解析
-
某硝酸盐受热分解生成金属氧化物、二氧化氮和氧气,生成的二氧化氮和氧气的物质的量之比为8:1,则金属元素的化合价在反应过程中的变化是
A. 升高 B. 降低 C. 不变 D. 无法确定
难度: 简单查看答案及解析
-
(题文)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2 (g)+4H2(g)
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,下列选项中各物理量的变化判断正确的是
A. 正反应速率减小 B. 逆反应速率增大 C. 平均相对分子质量不变 D. 转化率增大
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定的溶液中一定能大量共存的是( )
A. 能溶解Al2O3的溶液中:Mg2+、Fe3+、AlO2-、HCO3-
B. 水电离出c(H+)=10-9mol/L的溶液中:K+、Fe3+、Cl-、SO42-
C. 滴入KSCN显红色的溶液:Na+、Cu2+、Br-、SO42-
D. c(H+)/c(OH-)=1012的溶液中:NH4+、K+、HCO3-、NO3-
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 向FeCl3溶液中滴加HI溶液:Fe3++2I-=Fe2++I2
B. 用铜电极电解氯化钠溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A. Cl2通入NaOH溶液:Cl2+OH-=Cl-+ClO-+H2O
B. NaHCO3溶液中加入稀HCl:CO32-+2H+=CO2↑+H2O
C. NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3-
D. Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
难度: 简单查看答案及解析
-
下列有关电化学的说法正确的是
A. 铜的金属活泼性比铁弱,可在海轮外壳上镶入若干铜块以减缓铁腐蚀
B. 原电池中,一定由活泼性强的金属作负极,发生氧化反应
C. 原电池放电时的负极和电解池充电时的阴极均发生氧化反应
D. 可充电电池充电时,负极与电源负极相连,正极与电源正极相连
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 液溴应保存于带磨口玻璃塞的广口试剂瓶中,并加水“水封”以减少其挥发
B. 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
C. 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+
D. 氨气是一种碱性气体,可用P2O5或无水CaCl2干燥
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a>b
B. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ
C. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
D. 已知CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.1 kJ·mol–1,反应过程中使用催化剂,ΔH减小
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
B. 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA
C. NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA
D. 1 mol Fe在氧气中充分燃烧失去3NA个电子
难度: 中等查看答案及解析
-
实验室制取下列气体的实验正确的是( )
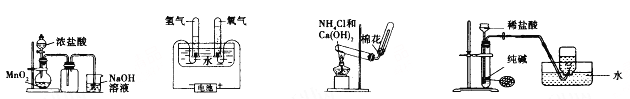
A. 实验室制氯气 B. 实验室制氧气 C. 实验室制氨气 D. 实验室制二氧化碳
难度: 中等查看答案及解析
-
硼氢化钠(NaBH4)在有机合成、化工生产方面有广泛应用。制备硼氢化钠的化学方程式为NaBO2+2SiO2+4Na+2H2
NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
A. 氧化产物和还原产物的物质的量之比为2:1
B. 转移4 mol电子时,只需向装置中通入44.8 L H2(标准状况)
C. 装药品之前加热装置至100℃并持续一会儿
D. 制备硼氢化钠的副产物可能有NaH
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
A. S
SO3
H2SO4 B. NH3
N2
HNO3
C. SiO2
Si
SiCl4
Si D. 海水
Mg(OH)2
Mg
难度: 中等查看答案及解析
-
CaCO3是一种化工原料,可以通过反应生成一系列物质,如下图所示。

下列说法正确的是( )
A. Cl2和SO2均可以漂白有色物质,且漂白的原理相同
B. 由SiO2+ Na2CO3
Na2SiO3+ CO2↑可知H2CO3的酸性强于H2SiO3
C. 工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3
D. 制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符合的是
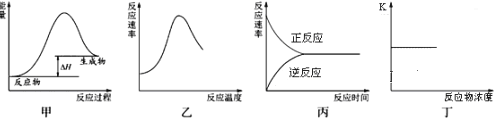
A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示可逆反应从加入反应物开始建立化学平衡的过程
D. 图丁表示可逆反应的平衡常数随反应物浓度的变化
难度: 中等查看答案及解析
-
阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,不正确的是
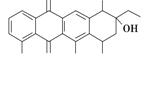
A. 阿克拉酮的分子式为C22H22O8
B. 分子中含有3个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质最多可与3 mol NaOH反应
难度: 中等查看答案及解析
-
下列实验现象、解释与结论均正确的是
编号
实验操作
实验现象
解释与结论
A
铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验
试纸变蓝
NO2为酸性气体
B
向某溶液中加入稀盐酸酸化的BaCl2溶液
有白色沉淀产生
该沉淀可能是BaSO4,该溶液中可能含有SO42-
C
向甲苯中滴入少量溴水,振荡,静置
溶液分层,上层呈橙红色,下层几乎无色
甲苯和溴水发生取代反应,使溴水褪色
D
将二氧化硅分别与氢氟酸溶液和氢氧化钠溶液反应
二氧化硅与氢氟酸反应生成气体,与氢氧化钠反应溶解
二氧化硅为两性氧化物
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是
实验
现象
结论
A
向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐期消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)<Ksp(AgCl)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下述实验中均有红棕色气体产生,对比分析所得的结论不正确的是
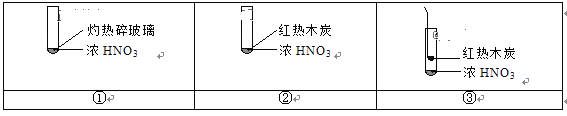
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
难度: 简单查看答案及解析
-
由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
烧渣
溶液
绿矾
铁黄
已知:FeS2和铁黄均难溶于水。
下列说法不正确的是( )
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O===15Fe2++2SO
+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
难度: 困难查看答案及解析
-
25 ℃时,在含CH3COOH和CH3COO-的溶液中,CH3COOH、CH3COO-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )
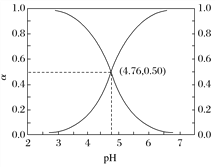
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变
难度: 困难查看答案及解析
-
温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号
物质的起始浓度(mol·L-1)
物质的平衡浓度(mol·L-1)
c(NO2)
c(NO)
c(O2)
c(O2)
I
0.6
0
0
0.2
II
0.3
0.5
0.2
Ⅲ
0
0.5
0.35
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
难度: 困难查看答案及解析